Pflanzenphysiologie
- Hill-Reaktion und Photosynthese -
- Versuch 4: Photosynthese: Hill-Reaktion
Einleitung:
1937 hatte Robert Hill den lichtabhängigen Elektronentransport der Photosyntheseprozesse an Thylakoidvesikeln mittels künstlicher Elektronenakzeptoren
nachgewiesen. Dabei konnte gezeigt werden, dass die an die Thylakoidmembran gebundenen Photo- und Redoxsysteme Elektronen übertragen und gleichzeitig
Sauerstoff entwicklen. Als Elektronenakzeptoren fungieren unter natürlichen Bedingungen Plastochinon (PS II) oder NADP+ (PS I), als
künstliche Akzeptoren lassen sich Ferricyanid (Fe(CN)6), DCPIP (2,6-Dichlorphenolindophenol), Eisenoxalat oder Benzochinon verwenden.
Die Hill-Reaktion lässt sich als Reaktionsgleichung wie folgt darstellen:
2 H2O + 4 A + hν --> 4 A- + 4 H+ + O2
Bei dieser Gleichung stellt A den Elektronenakzeptor dar.
Mit diesem Nachweis der Sauerstoffentwicklung war Hill massgeblich an der Aufklärung des Z-Schemas der Photosynthese beteiligt.[1]
Versuchsbeschreibung:
In diesem Versuch wurde mit isolierten Chloroplastenfragmenten von Spinat eine Hill-Reaktion mit Ferricyanid (Fe(CN6)) als Elektronenakzeptor bei unterschiedlichen Belichtungszeiten durchgeführt.
Versuchsdurchführung:
7 Reagenzgläsern wurden je 2,5 ml des Ferricyanid enthaltenden Reaktiongemisches (Zusammensetzung s.u.) zugegeben. 1 Reagenzglas wurde mit Alufolie umwickelt, um eine Lichteinwirkung zu unterbinden. Dieses Gefäss diente als Dunkelkontrolle. Alle Reagenzgläser wurden in einem Reagenglasständer vor eine 60 W Glühlampe aufgestellt, so dass jedes Reagenzglas etwa gleiche Lichtexposition aufwies. Dann wurde nach einem in Tabelle 1 dargestelltem Schema in unterschiedlichen Abständen jeder Probe jeweils 0,5 ml einer aus Spinat gewonnenen Chloroplastensupension mit einem Chlorophyllgehalt von 552 μg/ml hinzupipettiert und die erfolgende Hill-Reaktion nach verschiedenen Zeitintervallen durch Zugabe von 0,5 ml 14%iger Perchlorsäure (HClO4) abgestoppt. Dabei wurde nach jeweiliger Zugabe der Reagentien das Reagenzglas gut umgeschwenkt, um eine gleichmässige Durchmischung zu erzielen.
| Probennr. | Reaktionsbedingung (Licht/Dunkel) | Zeitpunkt der Zugabe der Chloroplastensuspension (min) | Zeitpunkt der Zugabe von Perchlorsäure (min) | Reaktionszeit (min) |
|---|---|---|---|---|
| 1 | Dunkel | 0 | 5 | 5 |
| 2 | Licht | 0 | 0 | 0 |
| 3 | Licht | 2 | 5 | 3 |
| 4 | Licht | 3 | 8 | 5 |
| 5 | Licht | 4 | 11 | 7 |
| 6 | Licht | 5 | 15 | 10 |
| 7 | Licht | 6 | 26 | 20 |
Nach Ablauf der Belichtungsreaktion wurden die Inhalte der Reagenzgläser in Zentrifugenröhrchen überführt und diese bei 3000 rpm für 5 min zentrifugiert. Mit dem entstandenen klaren Überstand wurde eine photometrische Analyse durchgeführt, wobei bei jeder Probe die Extinktion bei 420 nm gemessen wurde.
Zusammensetzung Ferricyanid Reaktionsgemisch:
- 100 mM Phophatpuffer pH 8,0
- 3 mM MgCl2
- 1,5 mM Ferricyanid
Ergebnisse:
Die Ergebnisse der photometrischen Messung sind in der folgenden Tabelle dargestellt, wobei die effektive Extinktion so ermittelt wurde, dass
von dem Extinktionskoeffizienten der Ausgangslösung, also der Extinktion des Ferricyanids, der Messwert subtrahiert wurde, um eine aufsteigende
Messreihe mit daraus resultierender positiver Steigung im Graphen zu erhalten, also die Zunahme der Konzentration der reduzierten Form des Ferricyanids
darzustellen. Dies kann man insofern durchführen, da man davon ausgehen kann, dass die Abnahme der Konzentration der oxidierten Form des Ferricyanids
in linearer Abhängigkeit zur Zunahme der Konzentration der reduzierten Form des Ferricyanids steht. Zugrundegelegt wurde dabei die Extinktion einer
millimolaren reinen Ferricyanidlösung in oxidiertem Zustand bei 420 nm von 1. Da die eingesetzte Konzentration der oxidierten Form des Ferricyanids
1,5 mM war, wurde der Minuend dementsprechend auf 1,5 extrapoliert.
| Probennr. | Messwert OD | effektive OD |
|---|---|---|
| 1 | 1,026 | 0,474 |
| 2 | 0,986 | 0,514 |
| 3 | 0,893 | 0,607 |
| 4 | 0,848 | 0,652 |
| 5 | 0,805 | 0,695 |
| 6 | 0,784 | 0,716 |
| 7 | 0,687 | 0,813 |
Der Graph der effektiven Extinktion gegen die Zeit ist in der folgenden Abbildung dargestellt. Dabei ist auf die Kurve der effektiven Extinktionen
eine lineare Gerade interpoliert worden.
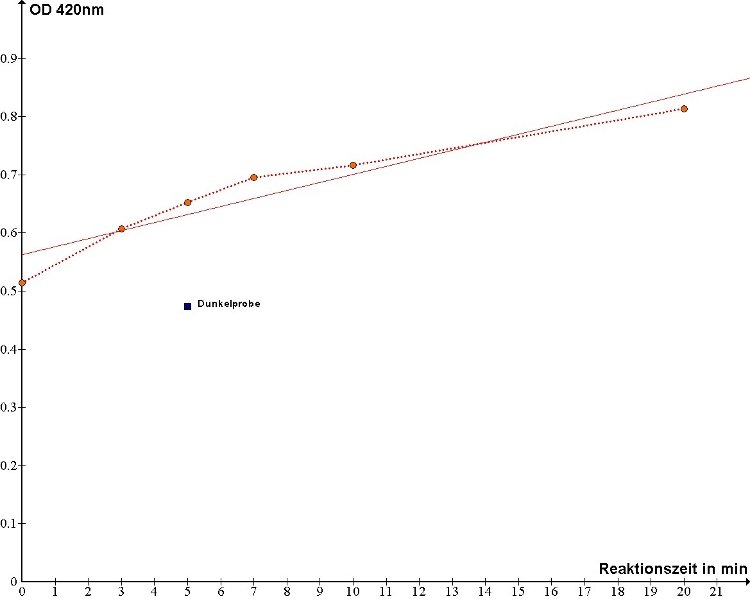
Abb. 1: Graph der effektiven Extinktion gegen die Reaktionszeit der Hill-Reaktion
Zur Ermittlung der Rate des photosynthetischen Elektronentransportes in der Einheit μmol FeCyred/ mg Chlorophyll × h wurde zunächst die Steigung der interpolierten linearen Gerade ermittelt und diese auf die Chlorophyllmenge und Zeiteinheit umgrechnet. Dabei wurde die Steigung durch die Berechnung des Steigungsdreiecks zweier willkürlich gewählter Punkte p1 und p2 der linearen Gerade ermittelt:
p1: x1 = 3,0; y1 = 0,605p2: x2 = 5,0; y2 = 0,631
Steigung m = y2 - y1/x2 - x1
m = 0,631 - 0,605/5 - 3 = 0,013
Damit entspricht die Zunahme der reduzierten Form des Ferricyanids 0,013 μmol pro Minute Reaktionszeit und pro Milliliter bei Annahme eines linearen Reaktionsverlaufes. Extrapoliert auf eine Stunde Reaktionszeit ergibt sich dann ein Wert von 0,78 μmol/h × ml (60 × 0,013). Da 0,5 ml einer Chlorophylllösung mit einem Chlorophyllgehalt von 552 μg/ml eingesetzt worden war, ergibt sich die Gesamtmenge des eingesetzten Chlorophyll zu 276 μg oder 276 × 10-6g bzw. 276 × 10-3 mg. Wird der obige Wert für die Ferricyanidred-Zunahme durch den Chlorophyllgehalt dividiert, ergibt sich eine Rate des photosynthetischen Elektronentransportes von 2,826 μmol FeCyred/ mg Chlorophyll × h. Da zur Entstehung eines Sauerstoffmoleküs 4 Elektronen benötigt werden (s. Gleichung Einleitung) und pro benötigtem Elektron ein FeCyred entsteht, lässt sich die Rate der photosynthetischen Sauerstoffentwicklung zu einem Viertel des Wertes des photosynthetischen Elektronentransports berechnen und man erhät eine Rate von 0,707 μmol O2/ mg Chlorophyll × h.
Referenzen:
[1] Wikipedia EN, Robert Hill
Die Graphik der Abb. 1 wurde mit Hilfe der Software 'Graph', Version 4.3 Build 384 erstellt. Diese Software ist unter der GNU General Public Licence erhältlich unter www.padowan.dk.