Pflanzenphysiologie
- CAM-Pflanzen -
- Versuch 5: CAM-Pflanzen
Versuchsbeschreibung:
In diesem Versuch wurde aus Homogenisaten aus Blättern von Kalanchoe blossfeldiana ("Flammendes Kätchen") die Gesamtsäure- sowie die Äpfelsäurekonzentration per Titration mittels NaOH bestimmt. Ferner wurde die Malat-Konzentration photometrisch durch enzymatische Umsetzung von Malat zu Oxalacetat bestimmt.
Versuchsdurchführung:
Die Versuchsdurchführung erfolgte gemäss den Anweisungen des Kursskriptes, wobei kleinere Abänderungen nachfolgend aufgeführt sind:
- Einwaage der Blätter: Hellprobe: 5,00 g; Dunkelprobe: 5,00 g
- Volumen der Überstände nach Zentrifugation: Hellprobe: 31,0 ml; Dunkelprobe: 31,5 ml
- Beim Mörsern der Blätter von Kalanchoe blossfeldiana wurde auf Zusatz von Wasser verzichtet
- Bei der Bestimmung der freien Säure und der Gesamtsäure wurden 20 μl Phenolphthalein zugesetzt
- Bei der enzymatischen Umsetzung von Malat zu Oxalacetat und der dabei erfolgenden photometrischen Messung wurde nach Abschluss der eigentlichen Messung 10 μl Äpfelsäure zugesetzt, um zu überprüfen, ob noch genügend Substrat (NAD+) vorhanden war, so dass eine unverfälschte Messung erfolgt war
Die Bestimmung der freien Säure mittels Titration der Homogenat-Überstände mit 0,02 N NaOH erbrachte folgendes Ergebnis:
Hellprobe: 1,4 ml
Dunkelprobe: 1,5 ml
Somit errechnet sich der Anteil an freier Säure wie folgt:
Da 1000 ml 0,02 N NaOH 0,02 Mol OH- enthalten, entsprechen 1,5 ml 0,00003 mol (0,02 Mol/1000 ml × 1,5 ml) oder 0,03 mmol
bzw. 30 μmol für die Dunkelprobe. Entsprechend errechnet sich für die Hellprobe ein Wert von 0,000028 mol oder 0,028 mmol bzw. 28 μmol.
Da 5 ml der Überstände verwendet wurden, müssen die Werte auf das Gesamtvolumen der Überstände extrapoliert werden. Damit ergeben
sich folgende Konzentration für die Extrakte (Titrationswerte / 5):
Hellprobe: 5,6 μmol/ml
Dies entspricht einer molaren Konzentration 5,6 mM.
Dunkelprobe: 6 μmol/ml
Dies entspricht einer molaren Konzentration von 6 mM.
Um den Gehalt an freier Säure im Frischgewicht zu erhalten, berechnet man zunächst die Gesamtmenge der freien Säure in den Überständen
(Konzentration der Extrakte × Gesamtvolumen der Extrakte) und dividiert den erhaltenen Wert durch das eingewogene Frischgewicht. Dann
erhält man folgende Werte für den Gehalt freier Säure pro Gramm Frischgewicht:
Hellprobe: 34,72 μmol/g
Dunkelprobe: 37,8 μmol/g
D.h. in den Blättern der im Hellen gezogenen Pflanzen war 34,72 μmol freie Säure pro g Frischgewicht enthalten
((5,6 μmol/ml × 31 ml) / 5,0 g), die Blätter der im Dunkeln gezogenen Pflanzen enthielten 37,8 μmol freie Säure pro g
Frischgewicht ((6 μmol/ml × 31,5 ml) / 5,0 g).
Siehe hierzu jedoch die Anmerkungen in der Ergebnisdiskussion.
Die Bestimmung der Gesamtsäure mittels Titration der mit Kationenaustauscher behandelten Homogenat-Überstände mit 0,02 N NaOH erbrachte
folgendes Ergebnis:
Hellprobe: 6,3 ml
Dunkelprobe: 8,9 ml
Damit errechnet sich der Anteil an Gesamtsäure wie folgt:
Da 1000 ml 0,02 N NaOH 0,02 Mol OH- enthalten, entsprechen 8,9 ml Titrationsvolumen der Dunkelprobe 0,000178 mol (0,02 Mol/1000 ml × 8,9 ml)
oder 0,178 mmol bzw. 178 μmol. Für die Hellprobe ergibt sich entsprechend ein Wert von 0,000126 Mol oder 0,126 mmol bzw. 126 μmol.
Da 5 ml des Gesamtvolumes eingesetzt wurden, errechnet sich der Anteil der Gesamtsäure am Volumen des gewonnenen Pflanzenextraktes dadurch, dass
man die Messwerte durch 5 dividiert. Dann ergen sich folgende Werte für den Anteil
der Gesamtsäure pro Volumeneinheit des Extraktes:
Dunkelprobe: 35,6 μmol/ml
Dies entspricht einer molaren Konzentration (Mol/Liter) von 35,6 mM.
Hellprobe: 25,2 μmol/ml
Dies entspricht einer molaren Konzentration (Mol/Liter) von 25,2 mM.
Der Anteil der Gesamtsäure am eingewogenen Frischgewicht errechnet sich dadurch, dass die molare Konzentration mit dem Gesamtvolumen multipliziert wird
und der erhaltene Wert durch den Wert der Einwaage des Blattmaterials dividiert wird. Dann erhält man folgende Ergebnisse:
Hellprobe: 156,24 μmol/g bzw. 0,16 mmol/g
Dunkelprobe: 224,28 μmol/g bzw. 0,22 mmol/g
Siehe hierzu jedoch die Anmerkungen in der Ergebnisdiskussion.
Die photometrische Bestimmung der Umsetzung der vollständigen Umsetzung von Malat zu Oxalacetat durch Malatdehydrogenase (MDH) erfolgte durch die
Bestimmung der Extinktion (OD) von NAD+ bei 340 nm. Dabei wurde eine Extinktionskoeffizient ε für NAD+ von
6,22 pro mM und cm Schichtdicke d der durchleuchteten Lösung zugrundegelegt. Da die verwendeten Küvetten genau 1 cm Schichtdicke für
die Lösung vorgeben, ergibt sich nach dem Lambert-Beer'schen Gesetz ein direkter Zusammenhang zwischen Extinktionsänderung ΔE
und Konzentration c von NADH gemäss c = ΔE / ε × d von
c = ΔE / 6,22 mM-1 cm-1 × 1 cm
Somit lässt sich die Konzentration von gebildetem NADH direkt in der Einheit μmol/ml durch Bildung der Differenz von der OD zum Ende der Reaktion
und der OD zum Zeitpunkt des Startes der Reaktion bestimmen. Im folgenden sind zunächst die Messwerte der Hell- und Dunkelproben tabellarisch
zusammengefasst.
| Zeitpunkt (in s ab t = 0) | Hellpflanze (OD) | Dunkelpflanze (OD) |
|---|---|---|
| 0 | 0,189 | 0,072 |
| 20 | 0,287 | 0,109* |
| 40 | 0,352 | 0,151 |
| 60 | 0,399 | 0,172 |
| 80 | 0,435 | 0,186 |
| 100 | 0,464 | 0,199 |
| 120 | 0,486 | 0,210 |
| 140 | 0,504 | 0,218 |
| 160 | 0,520 | 0,226 |
| 180 | 0,532 | 0,232 |
| 200 | 0,542 | 0,237 |
| 220 | 0,550 | 0,241 |
| 240 | 0,557 | 0,245 |
| 260 | 0,562 | 0,248 |
| 280 | 0,568 | 0,251 |
| 300 | 0,571 | 0,253 |
Die Graphen der gewonnenen Messwerte (OD gegen die Zeit) mit eingetragener, interpolierter, linearen Gerade ist in den folgenden Abbildungen dargestellt:
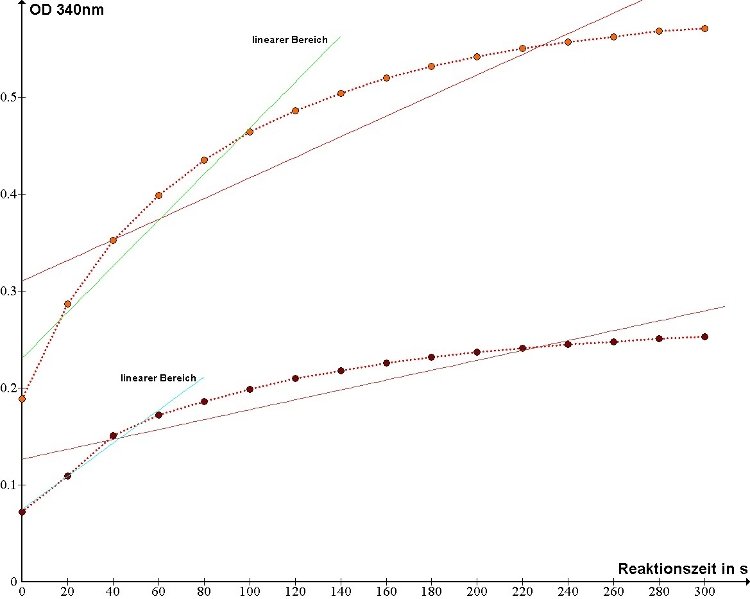
Abb. 1: Graph der Extinktion (OD) von NADH bei 340 nm gegen die Reaktionszeit
Die in den Graphen eingetragenen Geraden zeigen zwei unterschiedliche Interpolationen, einmal über den ganzen Messwertbereich und zwei Geraden,
bei denen der Wertebereich so ausgewählt wurde, dass sich in etwa ein linerarer Zusammenhang zwischen Zeit und gemesssener Extinktion ergibt.
Dies soll verdeutlichen, dass die Messwerte einen Sättigungskurvenverlauf aufweisen, was daher rührt, dass es sich bei
diesem Versuch um eine enzymatische Umsetzung handelt und die Enzymkinetik (also die Geschwindigkeit des enzymatischen Umsatzes) neben Temperatur und
anderen Faktoren (z.B. Salzkonzentration) auch abhängig von den Konzentrationen des Substrats und des Enzyms ist. Um für die Umsatzrate, also
Stoffmenge/Zeit (Mol/s) einen annähernd linearen Zusammenhang herzustellen, muss man sich hier auf den linearen Messbereich beschränken.
Damit ergibt sich graphisch eine Umsatzrate von 0,0024 μmol/ml × s für die Hellprobe und eine Umsatzrate von 0,0017 μmol/ml × s.
Für die Gesamtmenge an umgesetztem NADH ergibt sich nach obiger Formel des Lambert-Beer'schen Gesetzes für die Hellprobe 0,062 μmol/ml
((0,571 - 0,189)/6,22) und für die Dunkelprobe ein Wert von 0,029 μmol/ml ((0,253 - 0,072)/6,22).
Umgerechnet auf die eingesetzte Menge der jeweiligen Proben (Dunkelprobe 10 μl; Hellprobe 50 μl) ergeben sich folgende Werte für die umgesetzte
Menge von NADH:
Dunkelprobe: 2,9 μmol pro ml Probenmaterial
Hellprobe: 1,24 μmol pro ml Probenmaterial
Aus diesen Werten lässt sich der Gesamtgehalt an Malat in den Überständen der Blattextrakte durch Multiplikation mit dem Ausgangsvolumen ermitteln:
Dunkelprobe: 91,35 μmol
Hellprobe: 38,44 μmol
Damit errechnet sich der Gehalt an Malat pro Gramm Frischgewicht durch Division durch die jeweilige Einwaage zu:
Dunkelprobe: 18,27 μmol/g
Hellprobe: 7,69 μmol/g
Nach dem Erreichen eines gleichbleibenden Wertes wurde bei beiden Proben 10 μl 1 M Äpfelsäure zugesetzt, um zu überprüfen,
ob eine weitere Reaktion stattfindet oder evt. zuwenig NAD+ in der Lösung gewesen ist, was den Versuchsablauf verfälscht hätte.
Bei beiden Versuchsansätzen fiel diese Kontrollreaktion positiv aus, was durch deutliches Ansteigen der Extinktionswerte nach Zugabe der
Äpfelsäure beobachtet werden konnte.
Um den Anteil des Malats an der Gesamtsäure zu bestimmen, muss man in Betracht ziehen, dass Malat zweifach protoniert ist und
infolgedessen 2 OH--Gruppen bei der Neutralisation mit NaOH bindet, d.h. man muss die ermittelte Menge an Malat verdoppeln, um einen
äquivalenten Anteil an der titrierten Säure zu bekommen.
Somit ergibt sich eine Stoffmenge von 36,54 μmol Malat pro Gramm Frischgewicht für die Dunkelprobe und eine Stoffmenge von 15,38 μmol Malat pro Gramm
Frischgewicht für die Hellprobe. Der Anteil von Malat an der Gesamtsäure errechnet sich nun zu 16,55 % (36,54 / (220,72 / 100)) für
die Dunkelprobe und zu 9,69 % (15,38 / (158,76 / 100)) für die Hellprobe. Setzt man voraus, dass der Anteil der freien Säuren sich linear
proportional zur Gesamtsäure verhält, d.h. der Anteil der einzelnen Säuren an der Fraktion der gesamten freien Säure ist genauso hoch,
wie an der Gesamtsäure, würde man obige Prozentwerte auch für den Anteil von Malat an der freien Säure erhalten.
Ergebnisdiskussion:
Grundsätzlich sind alle gewonnenen Messwerte und die daraus berechneten Ergebnisse im Hinblick auf ihre Aussagekraft bezüglich der
absoluten Zahlenwerte mit Skepsis zu betrachten. Sie können nur die etwaige Grössenordnung angeben und eine Aussage über die Relation
zwischen den Proben machen. Dies hat seine Begründung darin, dass zum einen die Volumina recht "grob" ermittelt wurden oder z.B. Restsäure
in dem Pellet der Zentrifugation nicht erfasst wurde.
Ferner sind die Volumina der Titration recht grosszügig gewählt gewesen, hier hätte man eine genauere Abstufung im Bereich von
5 - 10 μl durchführen können. Insbesondere das Ergebnis der Titration der freien Säure muss bezweifelt werden, da hier nahezu identische
Werte erhalten wurden. Mögliche Ursachen auf Seiten der Versuchdurchführung könnte z.B. eine einfache Probenvertauschung gewesen sein,
so dass hier zweimal derselbe Ansatz titriert wurde. Sollten diese nahezu gleichen Werte kein Fehler in der Versuchsdurchführung gewesen
sein, könnte man darüber spekulieren, ob unter physiologischen Bedingungen tatsächlich unter Licht- und Dunkelbedingungen
ähnliche Werte im Gehalt an freier Säure aufrechterhalten werden können, z.B. durch übermässige Salzbildung.
Dies widerspräche jedoch den gemachten Erfahrung, dass sich bei der pH-Wert Messung an CAM-Pflanzen (z.B. am Presssaft von sukkulenten Blättern)
eben der typische Unterschied im pH des Zellsaftes zwischen Tag (basisch) und Nacht (sauer) ergibt,
so dass wohl eher von einem versuchsbedingten Fehler ausgegangen werden muss.
Bei der Enzym-Reaktion der Dunkelprobe ist insofern ein Messfehler aufgetreten, als das der mit '*' gekennzeichnete Wert aus zwei Werten gemittelt wurde,
da zu diesem Zeitpunkt keine korrekte Zeitnahme erfolgt war.
Die Unterschiede zwischen freier und Gesamtsäure ergeben sich dadurch, dass unter freier Säure jener Säureanteil verstanden werden muss,
bei dem die jeweilige Säure dissoziiert vorliegt, d.h. ihr Säurekation, das Proton H+, und ihr Säureanion
A- gelöst vorliegen. Bei der Gesamtsäure hingegen werden auch alle Säureanteile erfasst, die in Form ihrer Salze
oder vollkommen protoniert, z.B. als MalatH2 vorliegen. Um diesen Gehalt an Gesamtsäure zu bestimmen, werden mittels eines
Kationenaustauschers, an den die Kationen der jeweiligen Salze fester binden als an die jeweilige Ausgangssubstanz, die Kationen, wie z.B. Na+,
K+ o.a., durch H+-Protonen ausgetauscht, d.h. der Anteil der undissoziierten Gesamtsäure wird in freie Säure
umgewandelt. Der Unterschied zwischen dem Malat-Anteil und der Gesamtsäure ist dadurch zu erklären, dass innerhalb der Blattzellen
ja nicht nur Malat sondern im hohen Masse auch andere Säuren oder sauer reagierende Gruppen, wie z.B. Acetat, Pyruvat u.v.m. vorkommen,
so dass der Gesamtsäuregehalt durch alle sauer reagierenden Verbindungen und nicht nur durch Malat bestimmt wird. Allerdings hätte
man aufgrund der vorweg durch die Literatur bekannten Werte von pH-Wert Messungen erwarten können, dass der Malat-Anteil grösser ausfallen
würde, da diesem ja der hauptsächliche Einfluss der pH-Wert-Änderung zugeschrieben wird. [1]
Referenzen:
[1] Richter, 'Stoffwechselphysiologie der Pflanzen', 5. Auflage, Thieme Verlag 1988
Die Graphik der Abb. 1 wurde mit Hilfe der Software 'Graph', Version 4.3 Build 384 erstellt. Diese Software ist unter der GNU General Public Licence erhältlich unter www.padowan.dk.