Mikrobiologisches Praktikum
- Reinkulturgewinnung -
- Versuch D1: Gewinnung von Reinkulturen durch Verdünnungsausstriche
- Versuch D2: Katalasetest
Versuchsziel:
In diesem Versuch soll verschiedene Techniken des Verdünnungsausstriches (13-Strich- und 3-Ösenausstrich-Verfahren) zum Zwecke der Gewinnung von mikrobiellen Reinkulturen angewandt und erprobt werden.
Theoretische Grundlagen:
Um eingehendere Untersuchungen an Mikroorganismen machen zu können, ist es meist notwendig, dass der zu untersuchende Organismus in Reinkultur vorliegt,
um Experimente und daraus gewonnene Ergebnisse eindeutig einem Organismus zuordnen zu können.
Unter einer Reinkultur versteht man eine homogene Kultur von gleichartigen Organismen einer einzigen Art, die frei ist von Mikroorganismen anderer Art (sog. Kontaminanten).
Idealerweise sollte eine solche Kultur nur aus einer einzigen Zelle hervorgegangen sein, so dass man einen Klon erhält,
dessen Einzelorganismen genetisch untereinander (nahezu) identisch sind.
Da ein Verfahren zur Isolierung und Vermehrung einer einzigen Zelle in der Praxis meist zu aufwendig ist,
versucht man durch Verdünnung und Ausplattierung von Zellsuspensionen annähernde Ergebnisse zu erzielen.
Bei solchen Ausplattierungen kommt es zur Bildung von Kolonien, von denen, wenn sie isoliert gewachsen sind, man behaupten kann,
dass sie aus einer einzelnen Zelle oder zumindest aus einem Zellverband hervorgegangen sind.
Zweckmässiger Weise spricht man in diesem Fall von Kolonie bildenden Einheiten, abgekürzt KbE.
Solche Kolonien, die ja Populationen gleichartiger Organismen einer Art darstellen, lassen sich dann durch weiteres Überimpfen und Ausplattieren weiter vermehren und aufreinigen,
z.B. um vorhandene Kontaminanten zu eliminieren.
Um überhaupt eine Mikroorganismenart aus einer Mischpopulation zu gewinnen, muss man die zu isolierende Art meist anreichern (s. Versuch F) und dann aus der angereicherten Population versuchen,
den gewünschten Mikroorganismus zu isolieren.
Dazu bedient man sich selektiver Nährmedien, die dem zu isolierenden Organismus optimale Wachstumsbedingungen bieten, während sie andere, evt. konkurrierende Arten, benachteiligen.
Bei der nachfolgenden Vereinzelung benutzt man jedoch meist Universalnährmedien, um evt. Kontaminanten festzustellen.
Zum Zwecke des Vereinzelung werden verschiedene Verfahren angewandt, i.d.R. handelt es sich hierbei um Plattenverfahren,
d.h. um Verfahren, bei denen die zu behandelnde Kultur auf bzw. in einer Agarplatte ausgebracht wird.
Gängige Plattenverfahren sind das Guss- und das Spatelplattenverfahren (s.a. Versuch E2) und Verfahren des Verdünnungsausstriches.
Es existieren verschiedene Varianten des Verdünnungsaustrichs, von denen das 13-Strich-Verfahren und der 3-Ösenausstrich in diesem Versuch angewendet und nachfolgend kurz beschrieben werden. [1]
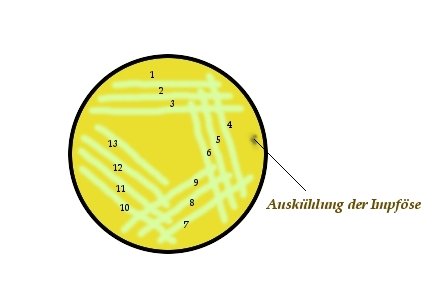
13-Strich-Verfahren:
Bei dem 13-Strich-Verfahren wird zunächst die Impföse ausgeglüht und diese auf dem Rand der zu beimpfenden Agarplatte abgekühlt.
Nun wird mit der Impföse ein Inokulum von der auszustreichenden Probe, i.d.R. eine Zelllsupension, entnommen und dann die Impföse am Rand der Platte leicht
aufgesetzt und ein erster Strich ausgezogen. Parallel dazu werden zwei weitere Striche ausgezogen, ohne dass diese sich untereinander berühren. Nun wird die Impföse
abermals ausgeglüht und abgekühlt. Eine solche Vorgehensweise, bei der die Impföse nach jeder Ausstrichserie ausgeglüht wird, soll den Erfolg der Vereinzelung
beträchtlich erhöhen und wird auch als fraktionierter Verdünnungsausstrich bezeichnet. Nun werden am Ende der ersten Ausstrichserie um ca. 90° versetzt drei weitere
parallele Ausstriche aufgebracht, derart, dass der erste Strich der zweiten Ausstrichserie alle drei Ausstriche der ersten Serie überstreicht, der zweite die letzten beiden
der ersten Ausstrichserie und der dritte bzw. insgesamt sechste Strich nur den dritten bzw. letzen Strich der ersten Ausstrichserie. Den Versatz um ca. 90° erreicht man am
zweckmässigsten dadurch, dass man die Petrischale in Richtung des gewünschten Ausstrichs dreht. Nun wird die Impföse abermals ausgeglüht, abgekühlt, die
Petrischale wiederum um 90° gedreht und nach gleichem Schema eine dritte Austrichserie, ausgehend von der zweiten Serie, aufgetragen. Dann wird die Impföse wieder
ausgeglüht, abgekühlt, die Petrischale abermals um 90° gedreht und eine vierte Ausstrichserie aufgebracht, mit dem Unterschied zu den vorhergehenden, dass zum Schluss
ein vierter, der insgesamt 13., Austrich aufgebracht wird, der keinen der vorhergehenden Ausstriche berührt. Nachfolgende Skizze soll das Ausstrich-Verfahren nochmals veranschaulichen:
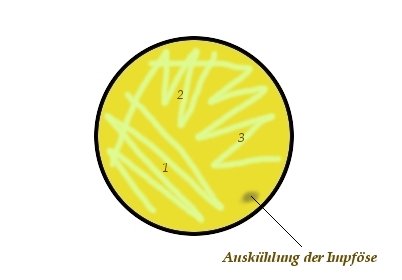
3-Ösenausstrich-Verfahren:
Auch hier wird die Impföse ausgeglüht und am Rand der zu beimpfenden Platte abgekühlt, bevor damit ein Inokulum aus der zu verdünnenden Probe aufgenommen wird.
Die Impföse mit dem Inokulum wird leicht auf den Agar aufgesetzt und dann von Rand zu Rand, allerdings ohne diesen zu berühren, in einer "Zick-Zack-Bewegung" bis etwa
zu einem Drittel bis zur Hälfte der Platte ausgestrichen. Die Impföse wird erneut ausgeglüht, abgekühlt, die Petrischale um ca. 90° gedreht und dann
der Ausstrich so angesetzt, dass hinter dem ersten Ausstrich aufgesetzt wird, Material von diesem aufgenommen wird, indem dieser überstrichen wird, und dieses Material weiter
auf der Platte durch erneute "Zick-Zack-Bewegung" verteilt wird. Die Impföse wird erneut ausgeglüht, abgekühlt, die Petrischale um ca. 90° gedreht und ein dritter
Ausstrich, analog dem Vorgehen des zweiten Ausstrichs, aufgebracht. Nachfolgende Skizze soll die Technik des 3-Ösenaustrichs noch einmal veranschaulichen:
Versuchsdurchführung:
1. Woche
In diesem Versuch wurden aus einer Mischkultur von Bacillus subtilis, Pseudomonas fluorescens und Rhodotorula glutinis mit zwei verschiedenen
Ausstrichverfahren, dem 13-Strich-Verfahren und dem Dreiösenausstrich-Verfahren, auf drei verschiedenen Nährböden (HPG-, KB- und YGC-Agar), fraktionierte
Ausstriche vorgenommen. Dazu wurden zunächst die schon fertig gegossenen und gebrauchsfertigen Agarplatten auf der Unterseite der Petrischalen beschriftet.
Die Nährmedien hatten folgende Zusammensetzung:
zu 1000 ml Aqua demin. wurden zugesetzt:
- 5,0 g Hefeextrakt
- 5,0 g Pepton aus Fleisch
- 0,25 g Glucose
- 15 g Agar
YGC-Agar
zu 1000 ml Aqua demin. wurden zugesetzt:
- 5,0 g Hefeextrakt
- 20,0 g D(+)-Glucose
- 0,1 g Chloramphenicol
- 14,9 g Agar
King B-Agar (KB)
zu 1000 ml Aqua demin. wurden zugesetzt:
- 20,0 g Protease-Pepton
- 10,0 g Glycerin (reinst)
- 1,5 g Magnesiumsulfat (MgSO4)
- 1,8 g Tri-Kaliumphosphat-3-hydrat (K3PO4 × H2)
- 15,0 g Agar
Von jedem der aufgeführten Agarplatten wurde je eine im 13-Strich-Verfahren und eine im Dreiösenausstrich-Verfahren beimpft, so dass 6 Agarplatten
erhalten wurden. Dazu wurde die bereitgestellte Zellsuspension mit der Mischkultur von Bacillus subtilis, Pseudomonas fluorescens und Rhodotorula glutinis
gut mit dem Reagenzglasmischgerät durchmischt, dann die ausgeglühte Impföse am Rande der KB-Agarplatte abgekühlt und ein Inokulum aus
der Suspension aufgenommen und dieses auf der Agarplatte im 13-Strich-Verfahren aufgebracht. Ebenso wurde der HPG-Agar und der YGC-Agar mit einem Inokulum
aus der Mischkultur im 13-Strich-Vefahren beimpft. Nun erfolgte der Ausstrich der Mischkultur im 3-Ösen-Ausstrich-Verfahren, wobei nacheinander der KB-, YGC-
und HPG-Agar mit der Impföse beimpft wurde. Nun wurden die beimpften Agarplatten mit der Unterseite nach oben inkubiert: Die HPG-Platten für 2 Tage bei 25 °C,
die YGC-Platten bei 25 °C für ca. 5 Tage und die KB-Platten bei 25 °C für 3 Tage.
2. Woche
In der zweiten Woche erfolgte die Ausstrichkontrolle. Dazu wurde jede Platte auf eine dunkle Unterlage (Labortisch) gelegt und daraufhin untersucht, ob Koloniebildung
erfolgt war und wenn ja, ob die enstandenen Kolonien auf den Linien des Ausstrichschemas lagen. Ferner wurde überprüft, ob die Vereinzelung von Kolonien sichtbar war,
d.h. ob einzelne Kolonien isoliert gewachsen waren und ob eine Kontamination mit anderen Keimen stattgefunden hatte (z.B.mit Luftkeimen), d.h. ob die sterile Arbeitsweise
erfolgreich gewesen war. Ferner wurden die enstandenen Kolonien makroskopisch charakterisiert.
Dann wurden von isoliert liegenden, gut gewachsenen Kolonien Zellsuspensionen von je Bacillus subtilis, Pseudomonas fluorescens und Rhodotorula glutinis
mit sterilem Wasser angefertigt. Dazu wurde von drei Reagenzgläsern mit sterilem Wasser der Inhalt über dem Waschbecken ausgekippt, so dass noch ein kleiner Rest in
den Reagenzgläsern verblieb. Dann wurde die Impföse ausgeglüht, eines der Reagenzgläser in die andere Hand genommen und der Deckel einer der YGC-Platten
mit guter Vereinzelung von Rhodotorula glutinis leicht angehoben, die Impföse am Rand der Agarplatte abgekühlt und etwas Zellmaterial von einer isoliert
liegenden Rhodotorula glutinis Kolonie aufgenommen, die Petrischale wieder geschlossen, der Wattestopfen des Reagenzglases abgezogen und die Impföse vorsichtig,
ohne die Wände des Reagenzglases zu berühren, zum Boden des schräg gehaltenen Reagenzglases eingeführt und das Inokulum durch leichtes hin- und herbewegen
in dem verbliebenen Wassertropfen suspendiert. Das Reagenzglas wurde wieder verschlossen und beschriftet, die Impföse im Innenkegel der Bunsenbrennerflamme getrocknet
und hernach ausgeglüht. Nach der gleichen Vorgehensweise wurde von der KB-Platte ein Inokulum von Pseudomonas fluorescens und von der HPG-Platte ein Inokulum von
Bacillus subtilis in den verbleibenden Reagenzgläsern suspendiert. Diese Suspensionen wurden benutzt, um weitere Ausstrichserien anzufertigen. Dazu wurden von
jeweils einer der Zellsuspension mit der Impföse ein Inokulum entnommen und auf einer bereitgestellten frischen HPG-Agarplatte im 13-Strich-Verfahren ausgestrichen, so dass
je ein beimpfter HPG-Agar mit Bacillus subtilis, Pseudomonas fluorescens und Rhodotorula glutinis erhalten wurde. Die Agarplatten wurden nun mit der Unterseite
nach oben inkubiert: Der Ausstrich von Bacillus subtilis für 2 Tage bei 25 °C, der von Pseudomonas fluorescens für 3 Tage bei 25 °C und derjenige
von Rhodotorula glutinis für 5 Tage bei 25 °C.
3. Woche
In der dritten Woche erfolgte die Ausstrichkontrolle der Ausstrichserie, wobei wiederum auf Homogenität, Vereinzelung und morphologische Charakteristik der Kolonien, sowie
Kontamination geachtet wurde.
Im nächsten Schritt wurde von einer bereitgestellten Reinkultur von Pseudomonas fluorescens je eine Schrägagarkultur und eine Kryokultur angefertigt.
Das bereitgestellte Schrägarröhrchen war mit HPG-Agar befüllt (Zusammensetzung s.o.) und das Kryomedium hatte folgende Zusammensetzung:
- 0,5 ml Nährlösung
- 0,5 ml 85%iges Glycerin
- 3 Glasperlen (aus dem Bastelbedarf)
Nährmedium
zu 1000 ml Aqua demin. wurden zugesetzt:
- 5,0 g Fleischpepton
- 3,0 g Fleischextrakt
Für die Beimpfung des Schrägagars wurde mit der ausgeglühten Impföse von der Agarplatte der Reinkultur reichlich Zellmaterial von einzeln liegenden Kolonien
aufgenommen und dann die Impföse in das schräg gehaltene Schrägagarröhrchen (mit der Agarseite nach oben) fast bis zum Boden eingeführt, ohne die Glaswand
oder den Agar zu berühren. In etwa 1 cm Entfernung vom Boden des Röhrchens wurde die Impföse auf den Agar aufgesetzt und dann in mäanderförmiger Bewegung
auf dem Agar nicht ganz bis zum oberen Ende des Agars ausgestrichen, ohne die Agaroberfläche zu verletzen. Das Schrägagarröhrchen wurde wieder verschlossen, beschriftet
und die Impföse ausgeglüht, um etwaiges, verbliebendes Zellmaterial zu vernichten. Das Schrägagarröhrchen wurde für 2 Tage bei 25 °C inkubiert.
Nun erfolgte die Inokulation der Kryokultur. Dazu wurde wiederum mit der ausgeglühten Impföse Zellmaterial von einzeln liegenden Kolonien der Reinkultur aufgenommen, das in der
anderen Hand gehaltene ca. 2 cm lange, 2 ml fassende Kryoröhrchen aufgeschraubt und das Inokulum in das Röhrchen eingeführt und gut mit dem Kryomedium verrührt.
Anschliessend wurde das Kryoröhrchen verschlossen, die Impföse wieder ausgeglüht und das Kryoröhrchen 5-mal invertiert, um den Inhalt gut zu durchmischen.
Dann wurde das Kryoröhrchen erneut aufgeschraubt und mit einer sterilen Pasteurpipette aus Kunstoff das Kryomedium entnommen, so dass nur die Glasperlen im Röhrchen
verblieben. Die Pasteurpipette wurde mitsamt dem Inhalt in den Autoklavenmüll überführt, das Kryoröhrchen beschriftet und bei -70 °C eingefroren.
4. Woche
In der vierten Woche wurde die Schrägagarkultur makroskopisch und mikroskopisch auf Homogenität bzw. Reinheit überprüft. Zu diesem Zweck wurde einmal die auf dem
Schrägagar gewachsenen Kolonien mit dem blossen Auge untersucht, dann wurde das Röhrchen unter eine UV-Lampe (Licht von 366 nm Wellenlänge) verbracht, um festzustellen
ob die Kolonien fluoreszieren und wenn ja, ob die Fluoreszenz gleichmässig auftritt. Ferner wurde mit ausgeglühter Impföse ein Inokulum entnommen und in einem Reagenzglas
in einem Tropfen sterilen Wassers suspendiert (Verfahren siehe oben). Von dieser Suspension wurde wiederum mit ausgeglühter Impföse ein Inokulum entnommen und auf einem
vorher mit Ethanol gereinigten Objektträger aufgestrichen. Nach dem Trocknen des Aufstrichs wurde der Objektträger bei 400-facher Vergrösserung im Hellfeld mikroskopiert.
Nun wurden 4 bereitgestellte, frische KB- und HPG-Agarplatten (je 2) beschriftet und aus der angefertigten Zellsuspension ein Inokulum entnommen und dieses auf dem KB-Agar im
13-Strich-Verfahren (s.o.) ausgestrichen. Ebenso erfolgte eine Beimpfung des HPG-Agars im Dreiösen-Ausstrich-Verfahren (s.o) mit einem Inokulum aus der angefertigten Zellsuspension.
Nun wurde das Kryoröhrchen aufgeschraubt und mit der ausgeglühten Impföse eine der Glasperlen aus dem Röhrchen entnommen, auf den KB-Agar verbracht und dort auf der
Agaroberfläche ausgerollt, wobei die Glasperle auf dem Agar verblieb. Mit erneut ausgeglühter Impföse wurde eine weitere Glasperle auf den HPG-Agar verbracht und dort
gleichmässig auf der Agaroberfläche ausgerollt. Alle beimpften Agarplatten wurden nun für 2 Tage bei 25° C inkubiert.
5. Woche
In der fünften Woche wurden alle Platten makroskopisch untersucht und auf Reinheit und Homogenität, sowie Kontamination überprüft. Ferner wurden alle
Agarplatten unter der UV-Lampe (366 nm) auf Fluoreszenz untersucht. Von dem Ausstrich der Kryokultur auf dem HPG-Agar wurde etwas Zellmaterial suspendiert und ein Inokulum hiervon
auf einen gereinigten Objektträger aufgebracht und dieser Ausstrich nach Trocknung bei 400-facher Vergrösserung im Hellfeld mikroskopiert (s. 4. Woche).
Die KB-Agarplatte des Ausstrich der Schrägagarkultur, sowie die HPG-Agarplatte der Kryokultur wurde beiseite gestellt und für den Katalasetest in Versuch D2 verwandt.
2. Woche
Das Wachstum der einzelnen Mikroorganismen entwickelte sich unterschiedlich: der YGC-Agar war überwiegend mit Rhodotorula glutinis, der KB-Agar überwiegend
mit Pseudomonas fluorescens und der HPG-Agar überwiegend mit Bacilus subtilis bewachsen.
Die Ausstrichkontrolle der HPG-, YGC- und KB-Agarplatten im 3-Ösenausstrich und 13-Strich-Verfahren erbrachte die in den folgenden Tabellen dargestellten Ergebnisse:
| Agar: | KB | YGC | HPG |
|---|---|---|---|
| +: gute Übereinstimmung -: keine Übereinstimmung ~: tlw. Übereinstimmung | |||
| 13-Strich-Verfahren: | ~ | - | + |
| 3-Ösenausstrich: | + | ~ | + |
| Agar: | KB | YGC | HPG |
|---|---|---|---|
| +: gute Vereinzelung -: keine Vereinzelung | |||
| 13-Strich-Verfahren: | + | - | + |
| 3-Ösenausstrich: | + | + | - |
| Agar: | KB | YGC | HPG |
|---|---|---|---|
| +: Kontamination -: keine Kontamination Name: Name der Kontaminante | |||
| 13-Strich-Verfahren: | + | P. fluorescens | + |
| 3-Ösenausstrich: | - | + | - |
Die Ergebnisse der Charakterisierung der Koloniemorphologie sind in der folgenden Tabelle dargestellt:
| Farbe | Durchmesser | Form | Rand | Profil | Oberfläche | Konsistenz | Nährbodenverfärbung | |
|---|---|---|---|---|---|---|---|---|
| YGC: Rhodotorula glutinis | rot | 1-2 mm | rund | glatt | konvex | glatt, glänzend | butterig | - |
| KB: Pseudomonas fluorescens | weiss | 1-4 mm | rund | glatt | flach | rauh | gelartig | - |
| HPG: Bacilus subtilis | weiss | 1-2 mm | rund | glatt | konvex | glatt, glänzend | schleimig | - |
3. Woche
Die Ausstrichkontrolle des zweiten Verdünnungsausstrichs auf HPG-Agar erbrachte folgendes Ergebnis:
Rhodotorula glutinis: kontaminiert (Kontaminante Rhizobium Sporen), gute Vereinzelung der Kolonien
Pseudomonas fluorescens: kontaminiert (Kontaminante Rhizobium Sporen), keine Vereinzelung der Kolonien
Bacillus subtilis: keine Kontamination, gute Vereinzelung der Kolonien
4. Woche
Die Überprüfung der Reinheit der Schrägagarkultur von Pseudomonas fluorescens ergab folgendes Ergebnis:
Fluoreszenz: gut
Makroskopische Homogenität: gut
Mikroskopische Homogenität: gut
5. Woche
Die Ausstrichkontrolle der Kryokultur und Schrägagarkultur von Pseudomonas fluorescens auf KB- und HPG-Agar ergab folgendes Ergebnis:
KB Schrägagar: fluoreszent, makroskopisch homogen, keine Kontamination
HPG Schrägagar: fluoreszent, makroskopisch homogen, keine Kontamination
KB Kryo: fluoreszent, makroskopisch homogen, kontaminiert mit Rhizobium
HPG Kryo: fluoreszent, makroskopisch und mikroskopisch homogen, keine Kontamination
Ferner war feststellbar, dass die Gelbfärbung der Kolonien auf dem KB-Agar stärker ausfiel, als auf dem HPG-Agar. Auch war das Wachstum auf den Kryokulturplatten
stärker, als auf den Schrägagarkulturausstrichen.
Ergebnisdiskussion:
Insgesamt war die Isolierung und Gewinnung einer Reinkultur, sowie die Verdünnungsausstriche befriedigend verlaufen. Dass zahlreiche Ansätze mit
Rhizobium kontaminiert waren, zeigt, dass selbst bei Einhaltung der Richtlinien für steriles Arbeiten, eine Kontamination mit Fremdkeimen erfolgen kann,
insbesondere dann, wenn die Konzentration der Kontaminante erhöht ist. Deshalb empfiehlt es sich, solche Arbeiten immer unter der Sterilbank durchzuführen,
um die Kontaminationsgefahr zu minimieren. Auch ist anzumerken, dass man normalerweise das Ausstrichverfahren mehrfach wiederholt, um zu gewährleisten, dass
keine Kontaminanten mehr in der Reinkultur anzutreffen sind.
In Abweichung von der Versuchsvorschrift wurden, aufgrund von Zeitmangel, nicht in allen Zwischenschritten Präparate angefertigt, die normalerweise zur
Überprüfung der Homogenität mikroskopiert werden. Dies würde man sicherlich bei der Gewinnung einer neuen Reinkultur anders handhaben.
Der Effekt aus der Auswertung der Ausstriche der Schrägagar- bzw. Kryokulturen, dass die Gelbfärbung stärker auf den KB-Agarplatten auftrat, ist
darauf zurückzuführen, dass der King-B Agar ein Differentialmedium ist, welches aufgrund seiner Eisenarmut die Bildung von
Siderophoren, z.B. Pyoverdine
(Pseudobactine)
bei Pseudomonas verstärkt. Diese Farbstoffe dienen Pseudomonas dazu, Eisen aus dem Medium in die Zelle aufzunehmen (über sogenannte funktionelle
Hydroxamat-Gruppen).
Nachzutragen bleibt noch die Berechnung der molaren Massen bzw. molaren Konzentrationen des King-B-Agars:
Die Angabe für die Zusammensetzung des King-B-Agars war auf 1000 ml Wasser (in, d.h. in 1000 ml Wasser gelöst) bezogen und in Masseeinheiten g angegeben,
so dass die molaren Konzentrationen fü die entsprechenden Substanzen berechnet werden mussten.
Rechnung:
Für Glycerin (C3H8O3) war eine Masse von 10 g angegeben.
Die molare Masse von C3H8O3 ergibt sich zu:
(12u * 3) + (16u * 3) + (1u * 8) = 92u entspricht 92 g/mol
Die Masse von 10 g pro 1 l ergibt also eine molare Konzentration von:
10 g / 92 g/mol = 0,1086 mol/Liter
Für Tri-Kaliumphosphat-3-hydrat (K3PO4 x 3 H2O) war eine Masse von 1,8 g pro 1000 ml angegeben.
Die molare Masse von K3PO4 x 3 H2O ergibt sich zu:
(39u * 3) + (31u * 1) + (16u * 4) + (6u * 1) + (16u * 3) = 266u entspricht 266 g/mol
Die Masse von 1,8 g pro l entspricht also einer molaren Konzentration von:
1,8 g / 266 g/mol = 0,0677 mol/Liter
Für Magnesiumsulfat MgSO4 war eine Masse von 1,5 g pro 1000 ml angegeben.
Die molare Masse von MgSO4 ergibt sich zu:
(24,3u * 1) + (32u * 1) + (16u * 4) = 120,3u entspricht 120,3 g/mol
Die Masse von 1,5 g pro l entspricht also einer molaren Konzentration von:
1,5 g / 120,3 g/mol = 0,0125 mol/Liter
Versuchsziel:
In diesem Versuch soll die Katalase-Aktivität verschiedener Bakterienkulturen (Pseudomonas fluorescens und Milchsäurebakterien) überprüft werden.
Theoretische Grundlagen:
Sauerstoff in seiner molekularen Form als O2 Molekül wirkt auf alle lebenden Zellsysteme aufgrund seiner Oxidationswirkung toxisch und wird auch als Zellgift bezeichnet.
In noch stärkerem Ausmass gilt dies für anaerobe Organismen,
da diese Sauerstoff nicht als terminalen Elektronenakzeptor der Atmungskette verwenden und ihn somit nicht in Form von Wasser (H2O) unschädlich machen können.
Die Aktivierung des Sauerstoffs kann 3 unterschiedliche Formen annehmen,
die alle von sogenannten Oxidasen katalysiert werden und bei denen folgende Intermediate (Zwischenprodukte) enstehen:
O2 + 4 e- -> O2- + O2- Oxid-Ionen
O2 + 2 e- -> O22- Peroxid-Ion
O2 + 1 e- -> O2- Superoxid-Ion
Für diese Sauerstoff-Ionen gilt in noch stärkerem Masse, was für molekularen Sauerstoff festgestellt wurde:
Sie sind sehr reaktive Reaktanden, die die Zelle und ihre Bestandteile nachhaltig schädigen können.
Daher haben die meisten Organismen Enzymsysteme, die die bei der Reduktion von Sauerstoff entstehenden Intermediate unschädlich machen.
Oxid-Ionen reagieren mit Protonen zu dem für die Zelle harmlosen Wasser, Peroxid-Ionen reagieren mit H+-Protonen zu Wasserstoffperoxid (H2O2),
welches ebenfalls sehr reaktiv und für die Zelle schädlich ist.
Das Superoxid-Ion reagiert mit Wasserstoffperoxid und Wasserstoffprotonen weiter zu molekularem Sauerstoff,
Wasser und dem Hydroxyl-Radikal, welches wiederum für die Zelle toxisch ist.
Die Folgereaktionen der Sauerstoffaktivierung sind nachfolgend noch einmal aufgeführt:
O2- + 2 H+ -> H2O
O22- + 2 H+ -> H2O2
O2- + H2O2 + H+ -> O2 + H2O + OH.
Um das entstehende Wasserstoffperoxid unschädlich zu machen, besitzen die meisten aeroben Organismen das Enzym Katalase,
welches H2O2 zu Wasser und molekularem Sauerstoff zersetzt:
2 H2O2 -> 2 H2O + O2
Ferner existieren noch Peroxidasen,
die in der Lage sind Wasserstoffperoxid durch Protonierung zu entgiften:
NADH2 + H2O2 -> NAD+ + 2 H2O
Um die Entstehung von Hydroxyl-Radikalen zu vermeiden, besitzen aerobe und
aerotolerante Organismen das Enzym Superoxid-Dismutase,
welches das Superoxid-Ion aus der Aktivierung des Sauerstoffs in das etwas unschädlichere Wasserstoffperoxid und molekularem Sauerstoff umwandelt:
2 O2- + 2 H+ -> H2O2 + O2
Anaerobe Organismen verfügen i.d.R. nicht über diese Enzymsysteme.
Die Katalasereaktion macht man sich bei der Charakterisierung von Mikroorganismen zunutze, indem man bei Organismen, die dieses Enzym besitzen,
die Gasentwicklung des molekularen Sauerstoffs beobachten kann.
Anhand dieser Reaktion können also aerobe von aneroben und meist auch von aerotoleranten Organismen unterschieden werden.
[2]
Versuchsdurchführung:
In diesem Versuch wurden die beiseite gelegten Agarplatten der Ausstriche von Pseudomonas fluorescens aus Versuch D1 (ein KB-Agar aus der Schrägagarkultur und eine HPG-Agarplatte aus der Kryokultur), sowie die Agarplatten der Ausstriche der Milchsäurebakterien aus Versuch H (ein M17-Agar mit Streptococcus und ein Rogosa-Agar mit Lactobacillus) einem Katalase-Test unterzogen. Zu diesem Zweck wurde die erste der Agarplatten gerade auf den Labortisch gestellt, der Deckel der Petrischale abgenommen und mit bereitstehender 3 %-iger Wasserstoffperoxidlösung (H2O2) aus einem kleinen Erlenmeyerkolben so übergossen, dass der Agar gleichmässig von der Flüssigkeit bedeckt wurde. Nun wurde kurz abgewartet, ob es zu einer Gasentwicklung in der Flüssigkeit über dem Agar kam und das Ergebnis notiert. Nach der gleichen Vorgehensweise wurden alle Agarplatten getestet. Die getesteten Agarplatten wurden in den Autoklavenmüll überführt.
Ergebnis:Sowohl der Katalase-Test mit dem KB-Agar der Schrägagarkultur, als auch dem HPG-Agar der Kryokultur verlief positiv, d.h. es war optisch eine starke Gasentwicklung feststellbar, die durch heftiges Aufschäumen und Blasenbildung der Flüssigkeit gekennzeichnet war. Bei beiden Agarplatten (M17-Agar mit Streptococcus und der Rogosa-Agar mit Lactobacillus) des Versuches H war keinerlei Gasentwicklung feststellbar.
Ergebnisdiskussion:
Als Ergebnis dieses Versuches lässt sich festhalten, dass Pseudomonas fluorescens Katalase-positiv ist und somit über das Schutzenzym Katalase verfügt,
während die Milchsäurebakterien Streptococcus und Lactobacillus Katalase-negativ sind und nicht über das Enzym Katalase verfügen. Somit
lässt sich Pseudomonas fluorescens als aerober Organismus und die Milchsäurebakterien als zumindest aerotolerante oder gar anaerobe Organismen klassifizieren.
Anzumerken ist noch, dass man das entstehende Gas auch auffangen und weiteren Untersuchungen unterziehen könnte, um zu verifizieren, dass es sich tatsächlich um
Sauerstoff (O2) handelt.
Referenzen:
[1] Bast, E. 'Mikrobiologische Methoden', 2. Auflage, Spektrum Akademischer Verlag 2001
[2] Fuchs, G. (Ed.) 'Allgemeine Mikrobiologie', 8. Auflage, Thieme Verlag 2007