Mikrobiologisches Praktikum
- Trinkwasseruntersuchung -
- Versuch J1: Trinkwasseruntersuchung nach dem Lebensmittel- und Bedarfsgegenständegesetz (LMBG)
- Versuch J2: IMViC Test
- Versuch J3: API 20E
Versuchsziel:
In diesem Versuch soll eine Bestimmung der Gesamtkeimzahl von Escherichia coli bzw. coliformen Keimen im Trinkwasser ermittelt werden.
Theoretische Grundlagen:
Gemäss der Trinkwasserverordnung 2001 werden Trinkwasserproben auf eine mesophile aerobe Gesamtkeimzahl (ISO 6222) und
die Anwesenheit von coliformen Bakterien, insbesondere von Escherichia coli, sowie von Enterokokken (ISO 9308-1) hin untersucht.
Die Vorgehensweise ist dabei durch das Lebensmittel- und Bedarfsgegenständegesetz (LMBG) und die Trinkwasserverordnung geregelt.
Mit diesen Regelwerken soll eine hohe Trinkwasserqualität gewährleistet werden, die nicht zuletzt darin besteht,
Kontaminationen bzw. eine "Verseuchung" des Trinkwassers mit pathogenen Keimen zu vermeiden bzw. eine solche zu überwachen.
Als primäre Kontaminanten kommen dabei Bakterien, die den Gastrointestinaltrakt des Menschen besiedeln, in Frage.
Unter diesen befinden sich u.U. auch Krankheitserreger, aber in der Trinkwasseruntersuchung geht es zunächst darum,
grundsätzlich zu überprüfen, ob und in welchem Ausmass eine Kontamination des Trinkwassers mit Fäkalwasser stattgefunden.
Fällt eine solche Untersuchung positiv aus, d.h. hat man coliforme Keime in einer Trinkwasserprobe nachgewiesen,
müssen weitere diagnostische Verfahren angewendet werden.
Unter coliformen Keimen versteht man dabei stäbchenförmige, gram-negative, fakultativ anaerobe Keime der Darmflora,
die in der Lage sind, Lactose zu verwerten.
Um coliforme Bakterien nachzuweisen, existieren verschiedene Methoden.
So wird bei der in diesem Versuch verwendeten Methode die zu untersuchende Probe auf einem Lactose-Agar inkubiert,
der durch eine Farbstoffreaktion mit Triphenyltetrazoliumchlorid (TTC) (Strukturformel s. Abb. 1) die Lactoseverwertung im Stoffwechsel der Bakterien anzeigt,
indem Lactose-positive Kolonien gelblich bis rötlich gefärbt erscheinen.
Bei dieser Farbstoffreaktion wird das ursprünglich farblose Tetrazolium-Salz TTC in die Zellen aufgenommen und
durch Anlagerung eines Wasserstoffprotons (H+) und zweier Elektronen (e-) zu einer unlöslichen, rötlich gefärbten Formazan-Verbindung reduziert.
Dieser Vorgang wird grösstenteils durch Dehydrogenasen katalysiert und kann zur Unterscheidung stoffwechselaktiver Zellen von inaktiven oder abgestorbenen Zellen genutzt werden.
Lassen sich auf dem Lactose-TTC-Agar Keime nachweisen, werden von den gebildeten Kolonien Inokuli entnommen und diese auf speziellen Nährböden weiter vermehrt,
um dann mit den vermehrten Keimen einen Oxidase- und einen Tryptophanase-Test durchzuführen.
Bei dem Oxidase-Test wird auf die Anwesenheit der terminalen Oxidase der Atmungskette geprüft; dies geschieht mittels kommerzieller Teststreifen (s.a. Abb. 2).
In dem auch als Indol-Test bezeichneten Tryptophanase-Test wird auf die Anwesenheit von Indol geprüft.
Dies ist ein indirekter Nachweis des Enzyms Tryptophanase, welches die Aminosäure Tryptophan in Indol,
Pyruvat und Ammoniak spaltet.
Zur Ermittlung der Gesamtkeimzahl benutzt man ein Plattengussverfahren, wobei die Agarplatten einmal bei Raumtemperatur (22 ±2 °C) und einmal bei Körpertemperatur (36 ±2 °C) inkubiert werden.
Hierbei darf die Gesamtkeimzahl aller Bakterien nicht grösser als 100 KbE pro ml Trinkwasser liegen; E. coli, Enterokokken und coliforme Keime dürfen überhaupt nicht auftreten.
Der Gesetzgeber drückt dies in einer Höchstkeimzahl von 0 KbE pro 100 ml Probenmaterial aus.
[1], [2], [3]
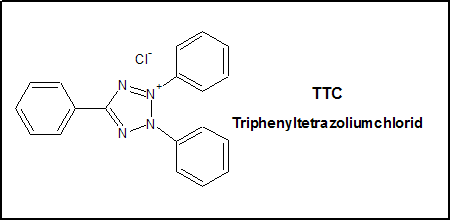
Abb. 1: Strukturformel TTC, Triphenyltetrazoliumchlorid
Versuchsdurchführung:
Von einem der Wasserhähne der Laborbank wurde von einem ca. bleistiftstarken Wasserstrahl eine Wasserprobe von ca. 500 ml in eine Glasflasche abgefüllt.
Mit jeweils einer frischen, sterilen Glaspipette wurden je 1 ml Wasser aus der abgefüllten Wasserprobe in vier Röhrchen mit bei 47 °C flüssig
gehaltenem Hefeextraktagar (Zusammensetzung s.u.) pipettiert. Die Wasserproben wurden durch schnelles Rollen der schräg gehaltenen
Röhrchen zwischen den Handflächen gut durchmischt und je in eine neue, leere Petrischale entleert. Nach Erstarren des Agars wurden 2 der Platten bei
22 °C für 68 h und die anderen beiden Agarplatten bei 36 °C für 44 h inkubiert. Nach der Inkubation wurden die gebildeten Kolonien auf den
Platten ausgezählt.
Im nächsten Versuchsteil wurde ein bereitgestellter Membranfilter aus einer Membranfiltration einer kontaminierten Wasserprobe untersucht.
Der Membranfilter war auf einem Lactose-TTC-Agar (Zusammensetzung s.u.) inkubiert worden und zeigte einen Bewuchs mit Kolonien von Escherichia coli und Serratia ficaria.
Von je einer E. coli und einer S. ficaria Kolonie wurde ein Inokulum in einem Wassertropfen suspendiert und im 13-Strich-Verfahren auf einem DEV-Nähragar I
(Zusammensetzung s.u.) ausgestrichen. Als Kontrolle wurde eine weitere Agarplatte mit einem Inokulum einer Reinkultur von Pseudomonas fluorescens
im 13-Strich-Verfahren beimpft. Die beiden Agarplatten mit E. coli und S. ficaria wurden bei 36 °C für 21 h und die Kontrolle mit P. fluorescens
bei 30 °C für 36 h inkubiert. Nun wurden je ein Röhrchen mit einem Tryptophan-Bouillon (Zusammensetzung s.u.) mit je E. coli und
S. ficaria beimpft und bei 44 °C für 21 h inkubiert.
Nach Ablauf der Inkubationszeit wurden die Kolonien der bebrüteten Agarplatten ausgezählt und mit einem Inokulum aus Kolonien von je einer der DEV I-Platten ein
Oxidase-Test durchgeführt. Dazu wurde das jeweils entnommene Inokulum auf einen Bactident®-Teststreifen des Herstellers Merck (s. Abb. 2)
aufgebracht und kurze Zeit (ca. 20-60 s) abgewartet, ob sich der Teststreifen verfärbt.
Mit den bebrüteten Röhrchen mit dem Tryptophan-Bouillon wurde jeweils ein Indol-Test durchgeführt.
Dazu wurden 12 Tropfen Kovac's-Reagenz (Zusammensetzung s. Versuch J2) auf das Tryptophan-Bouillon aufgetropft und einige Minuten abgewartet,
ob sich die charakteristische Rot-Verfärbung und Bildung eines "Indol-Ringes" an der Grenzfläche von Tryptophan-Bouillon und Luft einstellte.
zu 1000 ml Aqua demin. wurden zugesetzt:
- 15,0 g Agar
- 6,0 g Pepton aus Casein
- 3,0 g Hefeextrakt
Lactose-TTC-Agar
zu 1000 ml Aqua demin. wurden zugesetzt:
- 20,0 g Lactose
- 12,7 g Agar
- 10,0 g Pepton
- 6,0 g Hefeextrakt
- 5,0 g Fleischextrakt
- 0,1 g Tergitol® 7
- 0,05 g Bromthymolblau
- 0,025 g TTC (Triphenyltetrazoliumchlorid)
DEV-Nähragar I
zu 1000 ml Aqua demin. wurden zugesetzt:
- 18,0 g Agar
- 10,0 g Pepton aus Fleisch
- 10,0 g Fleischextrakt
- 5,0 g Natriumchlorid (NaCl)
Tryptophan-Bouillon
zu 1000 ml Aqua demin. wurden zugesetzt:
- 10,0 g Pepton aus Fleisch
- 1,0 g DL-Tryptophan
- 5,0 g Natriumchlorid (NaCl)
 |
 |
| Abb. 2: Merck Bactident® Oxidase Indikatorstäbchen |
Ergebnis:
Das Ergebnis der Kolonieauszählung ist in der folgenden Tabelle dargestellt:
| Temperatur: | 22 °C | 36 °C |
|---|---|---|
| Platte I: | 5 | 0 |
| Platte II: | 0 | 1 |
Aus der Auszählung ergibt sich für den 36 °C Ansatz ein arithmetisches Mittel von 0,5 KbE pro ml Probenmaterial und
für den Ansatz bei 22 °C ein arithmetisches Mittel von 2,5 KbE pro ml Trinkwasser.
Zusammengenommen ergibt sich damit eine gemittelte Keimbelastung von 1,5 KbE pro ml Trinkwasser.
Die Auswertung des Lactose-TTC-Agars ergab, dass E. coli gelbliche Kolonien und S. ficaria rötliche Kolonien gebildet hatten,
also beide Typen als Lactose-positiv und damit als coliforme Keime zu betrachten sind.
Dies bestätigt auch der Oxidase-Test und der Indol-Test auf Tryptophanase, dessen Ergebnisse in der folgenden Tabelle dargestellt sind:
| Test: | Oxidase | Indol |
|---|---|---|
| E. coli: | - | + |
| S. ficaria: | - | - |
| P. fluorescens: | + |
Die Ergebnisse des Indol-Tests sind auch in Abbildung 3 veranschaulicht, wo sich sehr deutlich die Bildung eines roten "Indol-Ringes" an dem Röhrchen mit dem E. coli-Ansatz zeigt.

Abb. 3: Indol-Test, links E. coli, rechts S. ficaria
Ergebnisdiskussion:
Zusammenfassend lässt sich feststellen, dass zwar die Gesamtzahl der Keimbelastung der Trinkwasserprobe unter der gesetzlichen Höchstgrenze von 100 Keimen pro ml lag, aber die Probe mit coliformen Keimen kontaminiert war, wovon einer durch die Charakteristik Lactose-positiv, Indol-positiv und Oxidase-negativ als Escherichia coli identifiziert wurde. Da laut Trinkwasserverordnung keine coliformen Keime enthalten sein dürfen, muss die Probe als belastet angesehen werden.
Versuchsziel:
In diesem Versuch soll das Differenzierungsverfahren IMViC für Enterobacteriaceae durchgeführt werden.
Theoretische Grundlagen:Als Erweiterung der in Versuch J1 durchgeführten Verfahren wurde in diesem Versuchsteil mit den Proben von E. coli und S. ficaria ein IMViC-Test durchgeführt. Dabei steht IMViC als Akronym für die Indol-, Methylrot-, Voges-Proskauer- und Citrat-Nachweisverfahren. Der Indol-Test ist, wie bereits in Versuch J1 dargestellt, ein indirektes Nachweisverfahren für das Enzym Tryptophanase. Bei dem Methylrot-Test wird aufgrund der pH-Wert indizierenden Wirkung des Methylrot-Farbstoffs auf eine generelle Säurebildung im Medium der Bakterien untersucht. Dabei geht es vor allem um den Nachweis von Stoffwechselprodukten der gemischten Säuregärung, die für viele Enterobacteriaceae, insbesondere E. coli charakteristisch ist. Gebildete Säuren sind vor allem Ameisen- und Essigsäure. Mit der Voges-Proskauer-Reaktion wird ein Sonderfall der gemischten Säuregärung untersucht, nämlich die Butandiolgärung. Bei diesem Stoffwechselweg wird über mehrere Zwischenschritte Butandiol als Endprodukt gebildet. Als eines der Intermediate wird Acetoin gebildet, welches durch Zugabe von α-Naphthol und Kalilauge (KOH) zu einem Diketon des Butans oxidiert wird (2,3-Butandion). Dieses bildet mit der Aminosäure Arginin oder mit Kreatin eine rotgefärbte Additionsverbindung, was sich in einem charakteristischen Farbumschlag der Probenlösung nach Rot äussert. Im Citrat-Test wird die Fähigkeit der Bakterien Citrat aufzunehmen überprüft. Dieser Test ist insofern von Bedeutung, als zwar viele Bakterien in der Lage sind, Citrat zu verwerten, aber nur einige befähigt sind, dieses auch aus dem umgebenden Medium aufzunehmen. Eine solche Aufnahme extrazellulären Citrats wird durch das Enzym Citratpermease ermöglicht. Im Citrat-Test wird also den Bakterien als einzige Nährstoffquelle Citrat im Probenmedium angeboten. Können die zu untersuchenden Bakterien dieses aufnehmen und verwerten, trübt sich die Probensuspension charakteristisch ein.
Versuchsdurchführung:
Mit dem Koloniematerial aus den DEV I-Nähragarplatten des Versuches J1 wurde je für E. coli und S. ficaria ein IMViC-Test durchgeführt.
Zu diesem Zweck wurden insgesamt 8 Reagenzgläser mit Inokuli von E. coli und S. ficaria beimpft:
je 2 Reagenzgläser mit einer DEV-Tryptophan-Bouillon Nährlösung (Zusammensetzung s.Versuch J1) für den Indol-Test,
je 2 Reagenzgläser mit einer komplexen Nährlösung (Zusammensetzung s.u.) für den Methylrot-Test,
je zwei Reagenzgläser mit einer komplexen Nährlösung (Zusammensetzung s.u.) für den Voges-Proskauer-Test und
je zwei Reagenzgläser mit einer Citrat-Nährlösung (Zusammensetzung s.u.) für den Citrat-Test.
Die Reagenzgläser wurden bei 35 °C für 2 Tage inkubiert.
An den inkubierten Röhrchen wurden dann die einzelnen Tests ausgeführt:
Für den Indol-Test wurde das Tryptophan-Bouillon mit 12 Tropfen Kovac's Reagenz (Zusammensetzung s.u.) überschichtet,
kurz umgeschwenkt und dann abgewartet, ob sich nach einigen Minuten der charakteristische Indol-Ring ausbildet (s.a. Vorgehensweise Versuch J1).
Für den Methylrot-Test wurde die komplexen Nährlösungen mit 5 Tropfen Methylrot-Reagenz (Zusammensetzung s.u.) versetzt und gut durchmischt.
Dann wurde überprüft, ob sich die Nährlösung rot verfärbte.
Für den Voges-Proskauer-Test wurden die komplexen Nährlösungen mit 3 ml Barritt's Reagenz (Zusammensetzung s.u.) versetzt und
anschliessend 1 ml 40 %-ige KOH zugetropft und gut durchmischt. Dann wurde überprüft, ob sich die Nährlösung rot verfärbte.
Bei dem Citrat-Test wurde überprüft, ob sich in dem inkubierten Reagenzglas eine Trübung eingestellt hatte.
zu 1000 ml Aqua demin. wurden zugesetzt:
- 7,0 g Pepton
- 5,0 g Glucose
- 5,0 g Di-Kaliumhydrogenphosphat (K2HPO4)
Voges-Proskauer-Nährlösung
zu 1000 ml Aqua demin. wurden zugesetzt:
- 7,0 g Pepton
- 5,0 g Glucose
- 5,0 g Di-Kaliumhydrogenphosphat (K2HPO4)
Citrat-Nährlösung
zu 1000 ml Aqua demin. wurden zugesetzt:
- 3,0 g Natrium-Citrat
- 1,5 g Natriumammoniumhydrogenphophat-Hydrat (NaNH4HPO4 x 4 H2O)
- 1,0 g Kaliumdihydrogenphosphat (KH2PO4)
- 0,2 g Magnesiumsulfat-Hydrat (MgSO4 x 7 H2O)
Kovac's Reagenz
- 3,0 g 4-Dimethylaminobenzalaldehyd
- 75 ml 1-Butanol
- 25 ml HCl konz.
Methylrot-Lösung
- 0,04 g Methylrot
- 60 ml Ethanol
- 40 ml Aqua dest.
Barritt's Reagenz
- 5,0 g 1-Naphthol
- in 100 ml Ethanol abs.
Ergebnis:
Die Ergebnisse der einzelnen Test der IMViC-Reihe sind in der folgenden Tabelle dargestellt und in den Abbildungen 1 und 2 veranschaulicht.
| Test: | Indol | Methylrot | Voges-Proskauer | Citrat |
|---|---|---|---|---|
| E. coli: | + | + | - | - |
| S. ficaria: | - | + | + | + |
 |
 |
| Abb. 1: IMViC Test Escherichia coli | Abb. 2: IMViC Test Serratia ficaria |
Ergebnisdiskussion:
Die Ergebnisse zeigen mit Erfolg, dass sich die untersuchten Bakterienarten aufgrund ihrer arttypischen Stoffwechseleigenschaften mit den Nachweisreaktionen der IMViC-Testreihe gut differenzieren lassen. Zu beachten ist hierbei allerdings, dass die Methylrot-Probe auch für S. ficaria positiv ausfiel, allerdings schwächer als bei E. coli. Dies bedeutet, dass bei S. ficaria auch saure Stoffwechselendprodukte in das umgebende Medium abgegeben werden und evt. eine Butandiol-Gärung als paralleler Stoffwechselweg neben der regulären gemischten Säuregärung existiert.
Versuchsziel:
In diesem Versuch soll das Schnellidentifikationsverfahren API 20E zur physiologischen Differenzierung von Enterobacteriaceae durchgeführt werden.
Theoretische Grundlagen:Der API 20E Test ist ein kommerzieller Test zur schnellen, routinemässigen Untersuchung von Enterobacteriaceae, der vor allem im medizinischen Bereich und der Lebensmitteldiagnostik eingesetzt wird. Er basiert auf verschiedenen Nachweisverfahren, in denen spezifische bakterielle Enzyme oder Stoffwechselprodukte bzw. deren ins umgebende Medium abgegebene Abbauprodukte mittels Indikatorreaktionen nachgewiesen werden. API 20E wird von bioMérieux, einem französischen Biotechnologie- und LifeSciences-Unternehemen, das sich selbst als Marktführer auf dem Gebiet der bakteriellen Diagnostik bezeichnet, hergestellt und besteht aus einem Teststreifen, auf dem 20 verschiedene Mikroröhrchen mit den entsprechenden Nachweisreagenzien in einer nebeneinander liegenden Reihe angeordnet sind. Diese Röhrchen werden direkt mit der zu untersuchenden Bakteriensuspension beimpft, evt. mit Paraffinöl überschichtet (für anaerobe Nachweisverfahren) und in einer speziellen Inkubationswanne bei 37 °C für 24 h bebrütet. Bei einigen Tests müssen abschliessend noch weitere Indikatorreagenzien aufgebracht werden. Diese Form des Nachweises physiologischer Merkmale, die meist auf charakteristischen Farbumschlägen der Indikatorsubstanzen beruhen, werden allgemein auch als "Bunte Reihe" bezeichnet. Ferner enthält der Teststreifen noch einige zusätzliche Testfelder zur Indikation von Oxidase, der Motilität, McConkey-Test und der Glucose-Oxidation bzw. Glucose-Fermentation. API 20E ist nur geeignet zur Diagnose von gram-negativen Stäbchen (Bacilli) und insbesondere von Enterobacteriaceae; andere Bakterientypen und -arten werden nicht erfasst oder ausgeschlossen. Die Auswertung erfolgt mittels eines vom Hersteller bereitgestellten Farbschemas, welches die einzelnen Farbreaktionen als positiv oder negativ klassifiziert. Nach dieser Klassifizierung wird ein Zahlencode ermittelt, welcher in einem 7-stelligem Ergebniscode resultiert. Diese Ergebniscode kann in einem Tabellenwerk des Herstellers nachgeschlagen werden und ermöglicht so die Zuordnung zu einer Bakterienart. [4] , [5]
Versuchsdurchführung:
Ein Indikationsstreifen des API20E-Tests des Herstellers bioMérieux wurde mit einem Inokulum einer der Bakterienarten aus Versuch J1 in einer Inkubationswanne
beimpft und für 24 h bei 37 °C inkubiert, wobei die Mikroröhrchen der Tests auf ADH (Arginindihydrolase), LDC (Lysindecarboxylase),
H2S (Schwefelwasserstoffbildung), ODC (L-Ornithin) und URE (Urease) mit Paraffinöl überschichtet wurden,
um eine anaerobe Reaktion zu gewährleisten.
Bevor die endgültige Auswertung vorgenommen werden konnte, mussten noch die TDA- (Tryptophan), IND- (Indolbildung) und VP-Test (Voges-Proskauer) an dem Teststreifen durchgeführt werden.
Zu diesem Zweck wurde in das mit VP gekennzeichnete Mikroröhrchen zunächst ein Tropfen der Reagenz VP 1 (bioMérieux 70 420, 40 %-ige KOH) und
dann ein Tropfen der Reagenz VP 2 (bioMérieux 70 430, α-Naphthol) aufgetropft.
Für den TDA-Test wurde wurde ein Tropfen der TDA-Reagenz (bioMérieux 70 400) in das Mikroröhrchen des entsprechenden Tests und
für den IND-Test ein Tropfen der James-Reagenz (bioMérieux 70 540) aufgetropft.
Für den Farbumschlag des VP-Test musste ca. 10 min gewartet werden, während die Farbreaktionen des TDA- und IND-Tests sofort eintraten.
Nachdem alle Tests durchgeführt waren, wurden die Farbreaktionen der einzelnen Tests anhand einer vom Hersteller beigelegten Ablesetabelle ausgewertet und
in ein Ergebnisblatt eingetragen. Auf dem Ergebnisblatt waren die einzelnen Test aufgeführt, wobei die Tests zu Gruppen á 3 angeordnet waren und
die Tests jeder Gruppe mit den Ziffern 1, 2 und 4 codiert waren. War das Ergebnis eines Tests positiv, wurde die zugeordnete Zahl gezählt und
die Zahlen jeder Gruppe zu einem Ergebniscode addiert.
Die sich aus dem Ergebnisblatt resultierenden Ergebniscodes konnten anhand eines Tabellenwerk des Herstellers ausgewertet werden.
Ergebnis:
Die Ergebnisse der einzelnen Test der API20E Testreihe sind in der nachfolgenden Tabelle dargestellt:
| Test: | ONPG | ADH | LDC | ODC | CIT | H2S | URE | TDA | IND | VP | GEL | GLU | MAN | INO | SOR | RHA | SAC | MEL | AMY | ARA | OX |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ergebnis: | + | - | - | - | + | - | - | - | - | + | + | + | + | + | + | + | + | + | + | + | - |
| Zahlencode: | 1 | 2 | 4 | 1 | 2 | 4 | 1 | 2 | 4 | 1 | 2 | 4 | 1 | 2 | 4 | 1 | 2 | 4 | 1 | 2 | 4 |
| Summencode: | 1 | 2 | 0 | 7 | 7 | 7 | 3 | ||||||||||||||
| Test: | ONPG | ADH | LDC | ODC | CIT | H2S | URE | TDA | IND | VP | GEL | GLU |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ergebnis: | + | - | - | - | + | - | - | - | - | + | + | + |
| Zahlencode: | 1 | 2 | 4 | 1 | 2 | 4 | 1 | 2 | 4 | 1 | 2 | 4 |
| Summencode: | 1 | 2 | 0 | 7 | ||||||||
| Test: | MAN | INO | SOR | RHA | SAC | MEL | AMY | ARA | OX |
|---|---|---|---|---|---|---|---|---|---|
| Ergebnis: | + | + | + | + | + | + | + | + | + |
| Zahlencode: | 1 | 2 | 4 | 1 | 2 | 4 | 1 | 2 | 4 |
| Summencode: | 7 | 7 | 3 | ||||||
Der sich ergebende Summencode lautete 1207773 und diesem Code war in dem Tabellenwerk des Herstellers Serratia ficaria zugeordnet.
Der Summencode von Escherichia coli, welcher von anderen Kursgruppen ausgewertet wurde, ergab 7044552.
Nachfolgend sind die einzelnen Kürzel der Testreihe mit denen von ihnen nachgewiesenen Reaktionen oder Enzymen aufgeführt:
ONPG: β-Galaktosidase
ADH: Arginin Dihydrolase
LDC: Lysin Decarboxylase
ODC: Ornithin Decarboxylase
CIT: Citratpermease
H2S: Schwefelwasserstoffbildung
URE: Urease
TDA: Tryptophan Desaminase
IND: Indol-Bildung
VP: Voges-Proskauer-Reaktion, Acetoinbildung
GEL: Gelatinase
GLU: Glucose-Oxidation
MAN: Mannit-Oxidation
INO: Inosit-Oxidation
SOR: Sorbit-Oxidation
RHA: Rhamnose-Oxidation
SAC: Saccharose-Oxidation
MEL: Melibiose-Oxidation
AMY: Amygdalin-Oxidation
ARA: Arabinose-Oxidation
OX: Oxidase
Ergebnisdiskussion:
Der Bestimmung der Bakterienart mittels der API20E-Testreihe ist erfolgreich verlaufen. Anzumerken ist noch, dass die Auswertung nicht ganz ohne
Schwierigkeiten verlief, da einigen Farbreaktionen nicht eindeutig ein positiver oder negativer Verlauf zuzuordnen war.
So hatte eine erste Auswertung positive ADH- und LDC-Werte ergeben; demnach hätte es sich bei der gesuchten Bakterienart um Enterobacter sakazakii handeln müssen,
was aber aufgrund der vorliegenden Informationen nicht sein konnte.
Nichtsdestotrotz ist es mit Testverfahren in der Art des API20E grundsätzlich möglich, ohne grossen labortechnischen Aufwand, mit geringer Probenmenge und relativ geringem Zeitaufwand eine Diagnose,
besonders medizinisch relevanter Bakterien durchzuführen.
Referenzen:
[1] Deutscher Verein des Gas- und Wasserfachs (DVGW), Trinkwasserverordnung
[2] Bundesministerium der Justiz, Lebensmittel-, Bedarfsgegenstände- und Futtermittelgesetzbuch (LFGB)
[3] PubChem Database, TTC
[4] bioMérieux Clinical Diagnostics, API® strips
[5] bioMérieux Clinical Diagnostics, API® / ID32 booklet (
Die chem. Strukturformel in Abb. 1 des Protokolls J1 wurde mit Hilfe der Software ACD/ChemSketch Freeware, release: 11.00, product version: 11.02 build 25941 (21 May 2008) erstellt. ACD/ChemSketch ist ein Produkt der Advanced Chemistry Development, Inc., Toronto, ON, Canada und erhältlich unter www.acdlabs.com