Mikrobiologisches Praktikum
- Anreicherung sulfatreduzierender Bakterien -
- Versuch M: Anreicherung Sulfat reduzierender Bakterien (Desulfovibrio)
Versuchsziel:
In diesem Versuch sollen Sulfat reduzierende Bakterien des Typs Desulfovibrio angereichert werden.
Theoretische Grundlagen:
Als "Desulfurikanten" werden obligat
anaerobe Bakterienarten bezeichnet,
die anaerobe Atmung betreiben und in der Lage sind Sulfat (SO4) als terminalen Elektronenakzeptor zu verwenden.
Das Sulfat wird dabei sukzessive über Sulfit (SO3) zu Schwefelwasserstoff (H2S) reduziert,
welches als solches an das umgebende Medium abgegeben wird.
Deshalb ist der charakteristische, stechende und nach "faulen Eiern" riechende Geruch des Schwefelwasserstoffs auch eines der Anzeichen für die Anwesenheit von sulfatreduzierenden Bakterien.
Als Substrat verwenden die Desulfurikanten niedermolekulare, organische Verbindungen, wie Ameisen-,
Essig-, Milch-,
Propion- oder Buttersäure,
Methanol, Ethanol
oder andere organische Verbindungen, wie z.B. Aromate.
Solche Sulfatreduzierer sind also chemoorganoheterotroph, da die organischen Verbindungen auch als Kohlenstoffquelle genutzt werden.
Es gibt allerdings auch Arten, die Wasserstoff als Elektronendonator verwenden und unter diesen wiederum welche, die Kohlendioxid als Kohlenstoffquelle verwenden.
Erstere sind dann als chemolithoheterotroph, letztere als chemolithoautotroph zu bezeichnen.
Die chemoorganotrophen Desulfurikanten werden überdies in unvollständige Oxidierer, die ihre Substrate nur bis auf die Stufe von AcetylCoA abbauen,
und vollständige Oxidierer, die ihre Substrate bis zu Kohlendioxid und Wasser oxidieren, unterschieden.
Ökologisch spielen die Desulfurikanten eine bedeutende Rolle, zum einen, weil sie die organischen Endprodukte aus Gärprozessen anderer Bakterien weiter oxidieren,
zum anderen weil sie Schwefelwasserstoff bereitstellen, der wiederum anderen Arten als Elektronendonator dient.
Ihr Lebensraum sind anaerobe, mit organischem Material versehene Sedimente, und unter diesen bevorzugt marine Sedimente, da das Meerwasser eine wesentlich höhere Sulfatkonzentration als Süsswasser aufweist.
Aber auch im Faulschlamm und in mit organischem Material verseuchten Grundwasser sind sulfatreduzierende Bakterien zu finden.
In ihrem Habitat sind sie verantwortlich für die Bildung schwarzer Sedimentschichten, die auf die Ausfällung von unlöslichem Eisensulfid zurückzuführen sind.
Taxonomisch sind Desulfurikanten in vielen Gruppen der Eubakterien (z.B. unter den gram-positiven oder den Proteobakterien)
und auch unter den Archaea zu finden.
Ferner werden die Desulfurikanten auch für die anaerobe Korrosion von Eisen verantwortlich gemacht, wobei die Meinungen über den genauen Mechanismus in der Literatur auseinandergehen.
So vermuten manche Autoren, dass die Bakterien durch direkten Kontakt mit dem Eisen (Eisen als Elektronendonator) dieses oxidieren, während andere davon ausgehen,
dass das Eisen erst durch oxidierten Wasserstoff oxidiert wird.
Einig bleibt man sich in dem, was auch beobachtbar ist, nämlich dass das Eisen oxidiert wird und sich mit dem dissoziierten Schwefelwasserstoff zu schwarzem Eisensulfid verbindet,
welches ausfällt und die oben bereits erwähnten schwarzen Ablagerungen bildet.
Dieses Phänomen hat auch wirtschaftliche Auswirkungen, da so unterseeische Pipelines oder andere Installationen, z.B. in der Erdöl- oder Gasförderung, angegriffen und korrodiert werden.
Der Desulfurikant Desulfovibrio, der in diesem Versuch angereichert werden soll, gehört taxonomisch zu den δ-Proteobakterien, ist also gram-negativ.
Desulfovibrio ist monopolar monotrich begeisselt und
ältere Stadien gehen von der gewöhnlichen Form der gekrümmten Stäbchen in pleomorphe Formen über.
Aufgrund der chemoorganotrophen Lebensweise wird dem Anreicherungsmedium Lactat zugesetzt.
[1]; [2]
Versuchsdurchführung:
Zunächst wurde ein Eisennagel mit einer Pinzette in der Bunsenbrennerflamme zum Glühen gebracht und dann vorsichtig in ein Reagenzglas mit 5 ml einer Lactat als Substrat enthaltenden Anreicherungslösung (Zusammensetzung s.u.) überführt. Dann wurde die Nährlösung mit 3 Tropfen Faulschlamm beimpft, mit einer Kapsenbergkappe (s. Abb. 1) verschlossen und im Anaerobentopf bei 25 °C für 2 Tage inkubiert. Nach dem Ablauf der Inkubationszeit wurde das Röhrchen leicht geöffnet und einer Geruchsprobe unterzogen. Ferner wurde eine Probe des Bodensatzes entnommen, suspendiert und ein Inokulum der Suspension mikroskopiert.
Lactat-Anreicherungslösungzu 1000 ml Aqua demin. wurden zugesetzt:
- 5,0 g Natriumlactat, 50 %-ige Lsg.
- 2,0 g Magnesiumsulfat-Hydrat (MgSO4 x 7 H2O)
- 1,0 g Hefeextrakt
- 1,0 g Ammoniumchlorid (NH4Cl)
- 1,0 g Calciumsulfat-Hydrat (CaSO4 x 2 H2O)
- 0,5 g Kaliumdihydrogenphosphat (KH2PO4)
- 0,5 g Eisensulfat-Hydrat (FeSO4 x H2O)
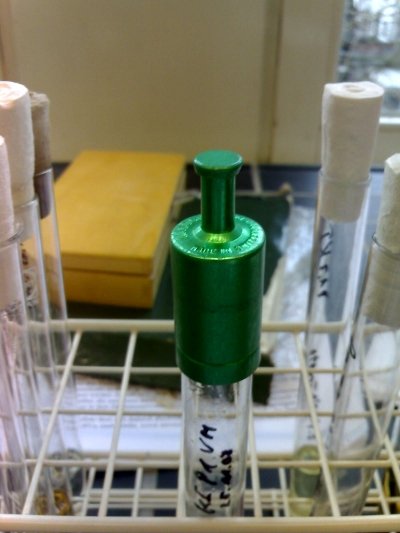
Abb. 1: Kapsenbergkappe
Ergebnis:
Das Nährmedium zeigte nach der Inkubation einen schwarzen Niederschlag (s. Abb. 2), der sich am Boden des Reagenzglases abgesetzt hatte und einen starken Geruch nach Schwefelwasserstoff aufwies. Das mikroskopierte Präparat zeigte eine homogene Zusammensetzung bakterieller Zellen.

Abb. 2: Eisensulfid Niederschlag
Ergebnisdiskussion:
Die Befunde der optischen Auswertung und der Geruchsprobe sind charakteristisch für sulfatreduzierende Bakterien, insbesondere Desulfovibrio. Der schwarze
Niederschlag entsteht durch die Freisetzung von Schwefelwasserstoff durch die Desulfurikanten, das zu gewissem Masse dissoziiert und sich mit dem Eisen zu unlöslichem,
schwarzen Eisensulfid verbindet, welches sich an dem Eisennagel und dem Boden des Reagenzglases absetzt. Auch der charakteristische starke Geruch nach Schwefelwasserstoff
ist auf die Stoffwechseltätigkeit der Desulfurikanten zurückzuführen, da diese mittels ihrer anaeroben Atmung Sulfat zu H2S reduzieren.
Somit lässt sich festhalten, dass die Anreicherung sulfatreduzierender Bakterien in diesem Versuch erfolgreich war, auch wenn der mikroskopische Befund keine weiteren
Ergebnisse erbrachte, da womöglich das Präparat nicht stark genug verdünnt gewesen ist, um charakteristische Einzelzellen aufzulösen.
Anzumerken bleibt noch, dass man zur Charkterisierung und Bestimmung der genauen Art der Desulfurikanten diese in Reinkultur bringen könnte, um weitergehende
Untersuchungen durchzuführen.
[1] Bast, E. 'Mikrobiologische Methoden', 2. Auflage, Spektrum Akademischer Verlag 2001
[2] Fuchs, G. (Ed.) 'Allgemeine Mikrobiologie', 8. Auflage, Georg Thieme Verlag 2007