Mikrobiologisches Praktikum
- Zellzahlbestimmung -
- Versuch E1: Mikroskopische Zellzählung in einer Zählkammer (Thomakammer)
- Versuch E2: Kulturelle Zellzahlbestimmung mittels Guss- und Spatelplattenverfahren
- Versuch E3: Indirekte Zellzahlbestimmung mittels Photometrie
Versuchsziel:
In diesem Versuch soll die Gesamtzellzahl einer Hefesuspension mittels einer Zählkammer (sog. Thomakammer) ermittelt werden.
Theoretische Grundlagen:
Eine Methode zur Ermittlung der Gesamtzellzahl einer mikrobiellen Kultur ist die direkte, mikroskopische Auszählung der Zellen in einer Zählkammer.
Die Gesamtzellzahl erfasst alle Zellen, also auch solche die noch mikroskopisch sichtbar, aber bereits abgestorben oder nicht mehr vermehrungsfähig sind.
Zählkammern existieren in verschiedenen Ausführungen und viele der verschiedenen Zählkammertypen wurden ursprünglich zur Zählung von Blutzellen entwickelt,
so z.B. die Neubauerkammer oder auch die hier verwendete Thomakammer.
Die in diesem Versuch verwendete Zählkammer besteht aus einer dicken, plangeschliffenen Glasplatte von der Grösse eines Objektträgers,
in die in der Mitte, quer zur Längsrichtung, drei Stege eingeschliffen sind, die durch Rinnen voneinander getrennt sind.
Der mittlere Steg liegt um einen definierten Betrag tiefer als die beiden seitlichen Stege, so dass nach Auflegen eines plangeschliffenen Deckglases,
dieses auf den seitlichen Stegen aufliegt und über dem mittleren Steg ein Hohlraum (die eigentliche "Kammer") genau definierten Volumens entsteht.
Auf dem mittleren Steg sind ein oder meist zwei durch eine Querrinne getrennte, feine, quadratische Liniennetze eingeschliffen.
Diese Liniennetze können je nach Hersteller oder Erfinder verschiedene Aufteilungen besitzen;
in der Mikrobiologie ist meist eine Netzteilung nach R. Thoma ("Thomakammer") [1] gebräuchlich,
bei der das gesamte Netzquadrat oder auch a-Feld eine Fläche von 1 mm2 hat und in 400 Kleinquadrate oder c-Felder von 1/400 mm2 eingeteilt ist.
Zusätzlich sind auf dem Netzquadrat 16 Gruppenquadrate á 16 Kleinquadrate durch entsprechende dickere Linien abgeteilt.
Diese Grossquadrate werden auch als Grossquadrate oder b-Felder bezeichnet.
Die Zählkammertiefe kann 0,02 mm oder 0,1 mm betragen, erstere wird zur Zählung von Bakterien, letztere für die Zählung von Hefen, Pilzsporen oder Algen verwandt.
Zur Auszählung suspendiert man die zu untersuchenden Mikroorganismen und bringt einen Tropfen der Suspension in die Zählkammer ein.
Unter dem Mikroskop werden dann bei 400-facher Vergrösserung und evt. eingeschalteten Phasenkontrast die in den Kleinquadraten eines Grossquadrates liegenden Zellen ausgezählt.
Es wird üblicherweise eine bestimmte Anzahl Grossquadrate ausgezählt, so dass mind. etwa 400 Zellen gezählt werden.
Die Anzahl Zellen pro c-Feld sollte zwischen 2 und 12 Zellen liegen und
die Konzentrationen der Ausgangssuspensionen sollte zwischen 2 × 107 und 3 × 10 8 Zellen/ml liegen,
um eine möglichst grosse Genauigkeit der Auszählung zu erhalten.
Das Zählkammerverfahren bietet den Vorteil möglichst schnell und ohne grösseren apparativen Aufwand Ergebnisse über die Gesamtzellzahl zu erhalten.
Auch können Zellverbände oder die durchschnittliche Anzahl Zellen pro Zellverband erfasst werden.
Jedoch ist die Auszählung von Bakterien mit erheblichen systematischen Fehlern behaftet, die zum einen durch die Adsorption der Bakterien an Glassoberflächen,
zum anderen durch Schwankungen in dem Zählkammervolumen, bedingt durch Kapillarkräfte, verursacht werden.
Die Auszählung von Hefezellen wird i.d.R. von den vorgenannten Fehlern nicht oder nur in geringem Ausmass beeinflusst.
Der Adsorptionseffekt lässt sich dadurch abschwächen, dass man die Ionenstärke der Suspension durch Zugabe von NaCl, K2HPO4 stark erhöht,
sowie anionische Tenside, wie Natriumdodecylsulfat zusetzt.
Bei Bakteriensuspensionen wird zusätzlich häufig Formaldehyd zur Unterdrückung der Beweglichkeit zugesetzt.
Ferner ist es sehr wichtig, dass die Mikroorganismen sehr homogen suspendiert sind und die Suspension gut gemischt ist,
so dass man eine möglichst gleichmässige Verteilung der Zellen in der Zählkammer erhält.
[2]
In diesem Versuch wurde zunächst die Zählkammer (Thomakammer), bestehend aus Zählkammerglas und Deckglas mit einem weichen, fusselfreien Tuch gereinigt, die Zählkammer gerade auf die ebene Arbeitsfläche des Labortisches aufgelegt und das Deckglas so aufgelegt, dass es die drei Stege der Zählkammer in Längsrichtung überdeckte. Dann wurde eine Hefesuspension, bestehend aus 1 g Bäckerhefe suspendiert in 1000 ml 0,9 %-iger Natriumchloridlösung, gut mittels Reagenzglasmischgerät (Vortex) durchmischt. Mit einer Pasteurpipette wurde etwas von der Suspension aufgenommen und ein kleiner Tropfen davon auf den mittleren Steg der Zählkammer dicht am Deckglasrand aufgesetzt, so dass die Hefesuspensionsflüssigkeit aufgrund der Kapillarkräfte zwischen Stegoberfläche und Deckglas gesaugt wurde, bis der Raum zwischen Mittelsteg und Querrinne gerade gefüllt war. Nun wurde die Zählkammer vorsichtig unter das Mikroskop gelegt und bei 100-facher Vergrösserung das Liniennetz des Mittelstegs scharf gestellt. Dann wurde auf 400-fache Vergrösserung umgestellt, die Schärfe nachjustiert und dann die Anzahl der zu beobachteten Zellen der Hefesuspension in 4 Grossquadraten (sog. b-Feld) á 16 Kleinquadrate (sog. c-Feld) gezählt. Dabei wurden nur die Zellen innerhalb der Kleinquadrate und jene auf den oberen und rechten Begrenzungslinien berücksichtigt, nicht jedoch solche, die auf der linken oder unteren Begrenzungslinie oder solche, die zwischen den Begrenzungslinien der Grossquadrate lagen. Nach der Auszählung wurden die Zählkammer samt Deckglas für 30 min in eine Kunststoffwanne mit Desinfektionsmittel eingelegt, anschliessend getrocknet und zurück in die Verpackung gelegt.
Ergebnis:Die Auszählung der 4 Grossquadrate bzw. b-Felder ergab die in den folgenden Tabellen dargestellten Ergebnisse:
| 1. c-Feld | 2. c-Feld | 3. c-Feld | 4. c-Feld | Summen: | |
|---|---|---|---|---|---|
| Summen: | 11 | 16 | 15 | 15 | Σ: 57 |
| 1. Reihe: | 4 | 6 | 7 | 4 | 21 |
| 2. Reihe: | 2 | 6 | 3 | 4 | 15 |
| 3. Reihe: | 1 | 0 | 2 | 4 | 7 |
| 4. Reihe: | 4 | 4 | 3 | 3 | 14 |
| 1. c-Feld | 2. c-Feld | 3. c-Feld | 4. c-Feld | Summen: | |
|---|---|---|---|---|---|
| Summen: | 15 | 15 | 11 | 18 | Σ: 59 |
| 1. Reihe: | 3 | 5 | 4 | 3 | 15 |
| 2. Reihe: | 4 | 5 | 5 | 3 | 17 |
| 3. Reihe: | 3 | 2 | 1 | 8 | 14 |
| 4. Reihe: | 5 | 3 | 1 | 4 | 13 |
| 1. c-Feld | 2. c-Feld | 3. c-Feld | 4. c-Feld | Summen: | |
|---|---|---|---|---|---|
| Summen: | 7 | 12 | 32 | 16 | Σ: 67 |
| 1. Reihe: | 4 | 2 | 8 | 3 | 17 |
| 2. Reihe: | 1 | 5 | 16 | 4 | 26 |
| 3. Reihe: | 0 | 2 | 4 | 5 | 11 |
| 4. Reihe: | 2 | 3 | 4 | 4 | 13 |
| 1. c-Feld | 2. c-Feld | 3. c-Feld | 4. c-Feld | Summen: | |
|---|---|---|---|---|---|
| Summen: | 14 | 21 | 26 | 22 | Σ: 83 |
| 1. Reihe: | 4 | 3 | 4 | 6 | 17 |
| 2. Reihe: | 4 | 7 | 9 | 3 | 23 |
| 3. Reihe: | 4 | 6 | 6 | 5 | 21 |
| 4. Reihe: | 2 | 5 | 7 | 7 | 21 |
Die Gesamtzellzahl aller ausgezählten Grossquadrate addierte sich somit zu 266 Zellen.
Damit ergab sich ein Mittelwert von 4,15625 Zellen pro ausgezähltem Kleinquadrat, was wiederum einer gemittelten Gesamtzellzahl von
16,625 x 106 Zellen in 1 ml Hefesuspension bzw. 16,625 x 109 Zellen in 1000 ml oder 1 g Hefe (Feuchtmasse) entsprach.
Ergebnisdiskussion:
Die Formel zur Berechnung der Gesamtzellzahl ergibt sich aus dem Volumen der Thomakammer:
Ein Kleinquadrat hat eine Kantenlänge von 0,05 mm und eine Höhe von 0,1 mm, damit
ergibt sich das Volumen eines c-Felds zu:
0,05 mm × 0,05 mm × 0,1 mm = 0,00025 mm3.
Da 1 ml 1000 mm3 entspricht, errechnet sich der Faktor des Kleinquadrats zu:
1000 mm3/0,00025 mm3 = 4 × 106.
Mit diesem Faktor muss nun die gemittelte Zellzahl pro ausgezähltem c-Feld multipliziert werde, um auf 1 ml zu extrapolieren.
Der Mittelwert ῡ berechnet sich aus der Gesamtzahl der Zellen aller ausgezählten Grossquadrate (≙ 266) geteilt durch die Anzahl der Grossquadrate (≙ 4)
mal der Anzahl der Kleinquadrate pro Grossquadrat (≙ 16):
ῡ = 266/4 × 16 = 4,156125
Mit oben bestimmten Faktor multipliziert, ergibt sich die Gesamtzellzahl pro 1 ml:
4,15625 × 4 × 106 = 16,625 × 106 Zellen/ml
Der erhaltene Wert liegt damit unter der empfohlenen Mindestverdünnung von 2 × 107 Zellen/ml und das Ergebnis kann in dieser Hinsicht in seiner
Genauigkeit bezweifelt werden. Auch ist anzumerken, dass aufgrund von Zeitmangel und in Abweichung von der Versuchsvorschrift nur 4 statt 10 Grossquadrate ausgezählt wurden,
was sich negativ auf die Genauigkeit auswirkt, da eine kleinere Stichprobe verwendet wude.
Ferner konnte von der Phasenkontrastvorrichtung des Mikroskops kein Gebrauch gemacht werden, da diese defekt war. Dies hatte aber keine Auswirkung auf die Auszählung, da die
Hefezellen auch gut im Hellfeld zu beobachten waren.
Wenn man die Häufigkeiten (s. Tab. 5) der Zählergebnisse mit dem Mittelwert vergleicht, scheint es, wenn man den
"Ausreisser"-Wert von 16 ausser acht lässt, dass die Häufigkeiten wenig um diesen streuen, also eine gute Durchmischung der Suspension stattgefunden hat.
Inwieweit sich das durch die statistische Auswertung bewahrheitet, soll untenstehende Berechnung veranschaulichen.
| Zählergebnis: | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Häufigkeit: | 4 | 6 | 11 | 18 | 8 | 5 | 4 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| Abweichung: | -3 | -2 | -1 | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| Abweichungsquadrat: | 9 | 4 | 1 | 0 | 1 | 4 | 9 | 16 | 25 | 36 | 49 | 64 | 81 | 100 | 121 | 144 |
| Summe Abweichungsquadrate: | 36 | 24 | 11 | 0 | 8 | 20 | 36 | 32 | 25 | 0 | 0 | 0 | 0 | 0 | 0 | 144 |
Aus der Häufigkeitsverteilung bzw. aus der Summe der Abweichungsquadrate lässt sich das mittlere Abweichungsquadrat bzw. Varianz s2 und die
Standardabweichung s auf Grundlage der Normalverteilung berechnen:
s2 = (36 + 24 + 11 + 0 + 8 + 20 + 36 + 32 + 25 + 144) / (4 × 16) - 1 = 236 / 63 = 3,74603
s = √ s2 = 1,9355
Die relative Standardabweichung bzw. Variationskoeffizient ergibt sich nun zu:
Vk = 1,9355 / 4,15625 = 0,46567
und der Standardfehler oder auch der mittlere Fehler des Mittelwertes zu:
sx = 1,9355 / √ 64 = 1,9355 / 8 = 0,2419375
Der relative Standardfehler oder auch Variationskoeffizient des Mittelwertes berechnet sich nun zu:
Vkx = 0,2419375 / 4,15625 = 0,05821
Damit erhält man einen prozentualen Fehler des Mittelwertes von 5,821 %.
Nun lässt sich die Gesamtzellzahl auch mit relativem Standardfehler ausdrücken:
Gesamtzellzahl: 16,625 × 106 Zellen/ml ± 5,821 % bzw.
Gesamtzellzahl: 16,625 × 106 Zellen/ml ± 9,677 × 105 Zellen/ml
Versuchsziel:
In diesem Versuch soll die Lebendzellzahl einer Hefesuspension mittels Gussplatten- und Spatelplattenverfahren ermittelt werden.
Theoretische Grundlagen:
Zur Ermittlung der Lebendzellzahl oder auch Keimzahl von mikrobiellen Proben oder Kulturen existieren verschiedene Methoden.
Bei allen wird die Zahl der vermehrungsfähigen Zellen pro Volumen (ml oder l) oder Masse (g) der zu untersuchenden Mikroorganismen ermittelt.
Da die kleinste vermehrungsfähige Einheit der Mikroorganismen die einzelne, zur Teilung befähigte Zelle ist,
zählt man normalerweise die gebildeten Kolonien von Ansätzen der Probe oder Kultur auf festen Nährböden (Plattenverfahren) aus.
Viele Mikroorganismen bilden jedoch Zellverbände aus, hängen zufällig zusammen oder sprossen (Hefen);
deshalb spricht man bei der Ermittlung der Lebendzellzahl häufig von Koloniebildenden Einheiten, abgekürzt KbE (engl. Colony Forming Units, abgekürzt CFU), um darzulegen,
dass Kolonien auch von mehreren Zellen gebildet werden können.
Das Plattenverfahren lässt sich in zwei Varianten durchführen;
dabei wird bei fakultativ oder
nicht sehr strikten anaeroben (aerotoleranten) Mikroorganismen vorzugsweise das
auf Robert Koch (1881) zurückgehende Gussplattenverfahren verwandt, während bei aeroben Mikroorganismen das Spatelplattenverfahren zum Einsatz kommt.
Bei beiden Verfahren werden Ansätze der Proben oder Kulturen (u.U. verdünnt) auf festen Nähragarböden ausgebracht und inkubiert.
Dabei wird beim Gussplattenverfahren die Probe mit unter den noch flüssigen Agar gemischt, mit diesem in eine Petrischale ausgegossen und erstarren lassen,
während beim Spatelplattenverfahren die Probe auf der Oberfläche der Nähragarplatte aufgebracht und gut mit einem Drigalskispatel verteilt wird.
Beide Verfahren haben ihre Vor- und Nachteile: So wird beim Gussplattenverfahren die Kolonieauszählung und Charakterisierung der Koloniemorphologie dadurch erschwert,
dass die Kolonien in den Agar eingewachsen sind.
Zudem muss die Probe mit dem noch flüssigen und daher noch warmen Agar vermischt werden, was u.U. zur Abtötung oder Beschädigung der Mikroorganismen und damit zur Ergebnisverfälschung führen kann.
Beim Spatelplattenverfahren ist zwar die Kolonieauszählung erleichtert, die Koloniemorphologie lässt sich eindeutiger charakterisieren und es findet keine Hitzebeschädigung statt,
aber die Gefahr einer Kontamination, vor allem durch Luftkeime, ist erhöht.
[2]
Als Ausgangsmaterial für diesen Versuch diente eine Suspension von Saccharomyces cervisiae, bei der 1 g Hefe in 99 ml 0,9 %-iger NaCl-Lösung suspendiert wurden, was einer Verdünnungsstufe von 10-2 oder 1:100 entspricht. Zunächst wurde von dieser Ausgangssuspension eine Verdünnungsreihe angelegt, die sowohl für das Gussplattenverfahren, wie auch für das Spatelplattenverfahren verwendet wurde. Es wurden jeweils 7 Verdünnungen angelegt, jede jeweils 10-fach verdünnt. Zunächst wurden 7 Röhrchen mit jeweils 9 ml physiologischer, 0,9 %-iger NaCl-Lösung bereitgestellt und mit den jeweiligen Verdünnungsstufen beschriftet, dann wurde mit einer sterilen Glas-Pipette 1 ml aus der Ausganssuspension entnommen und in das Röhrchen der nächst höheren Verdünnungsstufe überführt, so dass die neu erhaltene Konzentration nun 10-3 oder 1:1000 entsprach. Dieses wurde auf dem Reagenzglasmischgerät gut durchmischt und nun wiederum mit einer frischen, sterilen Glas-Pipette 1 ml der nun 1000-fach verdünnten Suspension entnommen und in das Röhrchen der nächst niedrigeren Konzentration überführt. Mit diesem Röhrchen (Verdünnung 10-4) wurde nun genauso verfahren wie in dem ersten Verdünnungsschritt. Nach demselben Prinzip wurden die weiteren Verdünnungsschritte durchgeführt, bis zu einer Verdünnung von 10-9.
Gussplattenverfahren:Es wurden 5 Petrischalen beschriftet und von der Verdünnung 10-9 mit einer sterilen Glas-Pipette 1 ml entnommen und in ein Röhrchen mit flüssigem Hefenähragar überführt, das kurz zuvor einem ca. 47 °C warmen Wasserbad entnommen wurde. Das Röhrchen wurde nun zwecks guter Durchmischung für ca. 10 s kräftig zwischen den Handflächen gerollt und dann in eine der Petrischalen entleert. Dabei wurde der Deckel der Petrischale nur leicht und derart angehoben, dass er über der unteren Schalenhälfte und dem Röhrchen gehalten wurde, um eine Kontamination mit Luftkeimen zu vermeiden. Nach der Entleerung des Röhrchens wurde der Deckel der Petrischale sofort wieder verschlossen und das eingegossene Gemisch durch leichtes Kreisen der Petrischale auf der Unterlage gleichmässig in der Schale verteilt und zwar so, dass das Hefenähragargemisch den Schalenrand und Deckel nicht benetzte. Mit den weiteren Verdünnungsstufen wurde genauso verfahren, so dass 5 Petrischalen mit gegossenen Hefenähragar-Gemischen in den Verdünnungsstufen 10-9, 10-8, 10-7, 10-6 und 10-5 erhalten wurden. Die Nährböden wurden nun für ca. 15 min. sich auskühlen und erstarren lassen und anschliessend bei 25 °C für 3-4 Tage inkubiert.
Der Hefenähragar hatte folgende Zusammensetzung:Zu 1000 ml Wasser wurden zugegeben:
- 10,0 g Hefeextrakt
- 30,0 g Saccharose
- 10,0 g Agar
In der zweiten Woche wurden die Platten ausgewertet, indem jede der Gussplatten mit der Unterseite nach oben auf eine dunkle Unterlage aufgelegt und die gebildeten Kolonien ausgezählt wurden. Dabei wurden nur Platten mit einer Koloniezahl von 30 - 300 Kolonien berücksichtigt und beim Auszählen die bereits gezählten Kolonien mit einem Filzstift markiert, um Doppelzählungen zu vermeiden.
Spatelplattenverfahren:Es wurden 5 Petrischalen mit Hefenähragar beschriftet und die erste der Petrischalen auf den Drehteller eines Drehtisches aufgesetzt und zentriert.
Der Hefenähragar hatte folgende Zusammensetzung:Zu 1000 ml Wasser wurden zugegeben:
- 10,0 g Hefeextrakt
- 30,0 g Saccharose
- 20,0 g Agar
Dann wurde mit einer sterilen Glasspipette 0,1 ml von der höchsten Verdünnungsstufe entnommen und vorsichtig auf die, auf dem Drehteller befindliche,
Hefenähragarplatte aufgetropft, so dass der Deckel der Petrischale nur leicht angehoben wurde, um eine Kontamination mit Luftkeimen zu vermeiden.
Anschliessend wurde ein Drigalskispatel in 96 %-igen Ethanol eingetaucht und unter der schwachen Bunsenbrennerflamme abgeflammt, um den Spatel zu sterilisieren.
Der Deckel der Petrischale auf dem Drehteller wurde leicht auf einer Seite angehoben und der Drigalskispatel wurde nun kurz auf der Hefenähragarplatte abgekühlt.
Dann wurde die Hefesuspension auf der Agarplatte mit dem Drigalskispatel verteilt, indem der Spatel für ca. 20 s leicht radial hin- und herbewegt wurde und
dabei mit der anderen Hand einerseits der Deckel über der Petrischale gehalten und andererseits der Drehteller sachte rotiert wurde.
Mit den weiteren Verdünnungsstufen wurde ebenso verfahren, so dass Spatelplatten mit den Verdünnungsstufen 10-9, 10-8, 10-7,
10-6 und 10-5 erhalten wurden. Die fertigen Agarplatten wurden mit der Unterseite nach oben für 3-4 Tage bei 25 °C inkubiert.
In der zweiten Woche wurden die Platten ausgewertet, indem jede der Spatelplatten mit der Unterseite nach oben auf eine dunkle Unterlage aufgelegt und
die gebildeten Kolonien ausgezählt wurden. Dabei wurden nur Platten mit einer Koloniezahl von 30 - 300 Kolonien berücksichtigt und
beim Auszählen die bereits gezählten Kolonien mit einem Filzstift markiert, um Doppelzählungen zu vermeiden.
Nach der erfolgten Auszählung wurden mit ausgeglühter Impföse ein Inokulum aus einer der Kolonien entnommen und
in einem Tropfen dest. Wassers in einem Reagenzglas suspendiert und gut durchmischt.
Anschliessend wurde mit der erneut ausgeglühten Impföse ein Tropfen der Suspension auf einen sauberen Objektträger gebracht,
etwas antrocknen lassen und dann bei 400-facher Vergrösserung im Hellfeld mikroskopiert.
Von den beobachteten Zellen wurde eine Zeichnung angefertigt (s. Anhang).
Abschliessend wurde die Koloniemorphologie mit blossem Auge und einer Lupe mit 10-facher Vergrösserung charakterisiert.
Ergebnis:
Das Ergebnis der Auszählung des Guss- und des Spatelplattenverfahrens ist in den folgenden Tabellen dargestellt:
| Verdünnungsstufe: | 10-9 | 10-8 | 10-7 | 10-6 | 10-5 |
|---|---|---|---|---|---|
| Anzahl Kolonien: | 16 | 122 | >300 | >300 | >300 |
| Verdünnungsstufe: | 10-9 | 10-8 | 10-7 | 10-6 | 10-5 |
|---|---|---|---|---|---|
| Anzahl Kolonien: | 0 | 7 | 30 | >300 | >300 |
Als Ergebnis der Kolonieauszählung für das Gussplattenverfahren erhält man, da nur ein brauchbarer Wert aus der Verdünnungsstufe 10-8 erhalten
wurde, den gewogenen Mittelwert dieser Verdünnungsstufe zu:
Cgew. = 122 × 108 Zellen / ml
oder bezogen auf die Ausgangsmenge von 1 g Hefe (Feuchtmasse) pro Liter Wasser zu:
Cgew. = 122 × 1011 Zellen / l
Ebenso erhielt man als Ergebnis der Kolonieauszählung für das Spatelplattenverfahren nur einen brauchbaren Wert aus der Verdünnungsstufe 10-7 den
gewogenen Mittelwert dieser Verdünnungsstufe zu:
Cgew. = 30 × 108 Zellen / ml
oder bezogen auf die Ausgangsmenge von 1 g Hefe (Feuchtmasse) pro Liter Wasser zu:
Cgew. = 30 × 1011 Zellen / l
Die Charakterisierung der Hefekoloniemorphologie ist in folgender Tabelle veranschaulicht:
| Parameter: | Farbe | Durchmesser | Form | Rand | Profil | Oberfläche | Konsistenz | Nährbodenverfärbung |
|---|---|---|---|---|---|---|---|---|
| Ausprägung: | creme-weiss | 1-3 mm | kleine, runde kegelige Häufchen | rund, glatt | kegelig | matt | cremig | - |
| Parameter | Ausprägung |
|---|---|
| Farbe: | creme-weiss |
| Durchmesser: | 1-3 mm |
| Form: | kleine, runde, kegelige Häufchen |
| Rand: | rund, glatt |
| Profil: | kegelig |
| Oberfläche: | glatt, matt |
| Konsistenz: | cremig |
| Nährbodenverfärbung: | - |
Zudem liess sich ein typischer Hefegeruch, der von den geöffneten Agarplatten ausging, feststellen.
Ergebnisdiskussion:
Die Berechnung des gewogenen Mittelwertes des Gussplattenverfahrens ist nachfolgend ausgeführt:
Cgew. = ( 122 / 1 × 1 ) × 108 = 122 × 108
Die Berechnung des gewogenen Mittelwertes des Spatelplattenverfahrens ist nachfolgend ausgeführt:
Cgew. = ( 30 / 1 × 1 ) × 107 × 10 = 30 × 108
Anzumerken ist, dass bei dem Spatelplattenverfahren gegenüber dem Gussplattenverfahren zusätzlich mit dem Faktor 10 multipliziert wurde, da anstatt 1 ml nur 0,1 ml
auf den Hefenähragarböden eingesetzt wurde.
Diese Werte sind insofern ohne grössere Aussagekraft, da nur eine auszählbare Platte pro Verfahren als Stichprobe erhalten wurde. Um ein aussagekräftiges Ergebnis
mit hinreichender Genauigkeit zu erhalten, ist es sicherlich notwendig mehrere Parallelplatten einer Verdünnungsstufe anzusetzen und auszuzählen. Wünschenswert
wäre überdies auch auszählbare Platten über mehrere Verdünnungsstufen zu erhalten, weil auch nur dann die Ermittlung eines gewogenen arithmetischen
Mittelwertes sinnvoll ist. Bei einer einzigen oder mehreren Platten einer einzigen Verdünnungsstufe ist die Berechnung des normalen arithmetischen Mittelwertes vollkommen
ausreichend.
Fragwürdig macht das Ergebnis auch die Tatsache, dass beim Spatelplattenverfahren, zumindest bei den niedrigeren Verdünnungsstufen, weniger Kolonien gezählt
wurden, als bei den vergleichbaren Verdünnungsstufen des Gussplattenverfahrens, obwohl man normalerweise davon ausgeht, das beim Spatelplattenverfahren wesentlich
mehr (und grössere) Kolonien produziert werden, da diese unter aeroben Bedingungen und damit mit höheren Stoffwechselraten wachsen können und auch keine
Hitzeschädigung der Zellen erfolgt. Ursache könnten Pippetierfehler oder Ungenauigkeiten beim Ausspateln sein; andererseits kann ein solches Ergebnis auch zufällig
sein (z.B. Fluktuationen in der lokalen Zelldichte der Suspension), so dass man dies nur bei einer grösseren Anzahl untersuchter Platten mit Bestimmtheit feststellen kann.
Versuchsziel:
In diesem Versuch soll die Zellzahl einer Hefesuspension mittels der Photometrie ermittelt werden.
Theoretische Grundlagen:
Bei der Photometrie macht man sich die Eigenschaft von Suspensionen zunutze, dass diese Licht streuen und zwar in um so grösseren Umfang,
je mehr Zellen sich in der Suspension befinden, je trüber das Medium also wird.
Daher spricht man auch von Trübungsmessung oder Turbidimetrie.
Dazu wird monochromatisches Licht (Licht einer Wellenlänge) bekannter Intensität durch die zu untersuchende Probensuspension gesandt und photoelektrisch ausgewertet,
wieviel der ursprünglichen Intensität noch vorhanden ist.
Dabei wird die Lichtabsorption vernachlässigt.
Dieser Wert wird als dimensionloser OD (Optische Dichte) Wert oder als Extinktion ausgegeben.
Führt man Messung mit Lösungen bekannter Konzentration (Zelltrockenmasse pro Volumen) durch,
kann man eine Eichkurve erstellen und anhand dieser Eichwerte Proben unbekannter Konzentration einordnen und bestimmen.
Ist zusätzlich noch die Gesamt- oder Lebendzellzahl der Eichkonzentrationen bekannt,
dann kann indirekt über die Konzentrationsermittlung die Keimzahl bestimmt werden.
Photometrische Methoden eignen sich besonders für Untersuchungen vegetativer Bakterien- oder Hefekulturen und deren Wachstum.
Ungeeignet sind photometrische Untersuchungen an mycelbildenden Organismen oder Suspensionen die so verunreinigt sind,
dass Lichtstreuung an anderen Partikel, als an den zu untersuchenden Zellen erfolgt.
Auch sollten die suspendierten Zellen nicht zu klein oder zu gross sein (0,1 - 5 μm3) und möglichst nicht in einem aggregierten Zustand vorliegen.
Grundlage der Trübungsmessung ist das Lambert-Beer'sche Gesetz, welches besagt,
dass die Streuung von durch Flüssigkeiten fallendes Licht der Anzahl (Konzentration) der streuenden Partikel in der Flüssigkeit und der Schichtdicke des durchstrahlten Mediums proportional ist.
Das Lambert-Beer'sche Gesetz ausgdrückt als Formel [2]:
Φex = Φin × e-sn × c × d
Dabei ist:
Φex: eingestrahlte Lichtintensität bzw. eintretender Strahlungsfluss
Φin: ausgestrahlte Lichtintensität bzw. austretender Strahlungsfluss
e: Basis des natürlichen Logarithmus 2,71828
sn: natürlicher Streukoeffizient
c: Partikelkonzentration
d: Schichtdicke
Für diesen Versuch wurden von 10 ml einer Hefesuspension, bestehend aus 2,5 g Feuchtmasse von Saccharomyces cerevisiae (Bäckerhefe) suspendiert in 1000 ml
0,9 %-iger NaCl-Lösung, 5 Verdünnungsstufen angefertigt. Zu diesem Zweck wurden 7 Einweg-Kunstoff-Küvetten mit den einzelnen Verdünnungsstufen beschriftet und
zwar so, dass die klaren, durchsichtigen Flächen der Küvetten, durch die der Lichtstrahl fällt, frei blieben. Dann wurden die, den einzelnen Verdünnungsstufen,
entsprechenden Mengen einer 0,9 %-igen NaCl-Lösung mittels einer Mikroliterpipette direkt in die Küvetten pipettiert. Küvetten 1 und 2 blieben zunächst leer,
in Küvette 3 wurde 0,5 ml, in Küvette 4 0,6 ml, in Küvette 5 0,7 ml, in Küvette 6 0,8 ml und in Küvette 7 0,1 ml NaCL-Lösung pipettiert. Nun wurden
den Küvetten die Hefesuspension zugesetzt: In Küvette 2 wurde 1 ml der unverdünnten Suspension pipettiert, Küvette 3 erhielt 0,5 ml Hefesuspension,
Küvette 4 0,4 ml, Küvette 5 0,3 ml, Küvette 6 0,2 ml und Küvette 7 0,1 ml der Hefesuspension. In die Küvette 1 wurde 1 ml einer Hefesuspension aus Versuch
E2 pipettiert, bestehend aus einer 9 %-igen NaCL-Lösung mit einer Konzentration von 10 g Hefe (Feuchtmasse) pro 1 l.
In der nachfolgenden Tabelle sind die Verdünnungsschritte der Übersichtlichkeit halber noch einmal dargestellt:
| Küvettennr. | Verdünnungsschritt | Hefe-Konzentration in g/l | Hefekonzentration in % |
|---|---|---|---|
| 1 | Suspension E2 | 10 | 1 |
| 2 | Suspension E3 unverdünnt | 2,5 | 0,25 |
| 3 | 0,5 ml Suspension E3 + 0,5 ml NaCL-Lösung | 1,25 | 0,125 |
| 4 | 0,4 ml Suspension E3 + 0,6 ml NaCL-Lösung | 1 | 0,1 |
| 5 | 0,3 ml Suspension E3 + 0,7 ml NaCL-Lösung | 0,75 | 0,075 |
| 6 | 0,2 ml Suspension E3 + 0,8 ml NaCL-Lösung | 0,5 | 0,05 |
| 7 | 0,1 ml Suspension E3 + 0,9 ml NaCL-Lösung | 0,25 | 0,025 |
Alle Küvetten wurden nun mit einem dünnen Streifen Parafilm verschlossen und zum Photometer verbracht, um eine Trübungsmessung bei monochromatischem Licht von 600 nm Wellenlänge vorzunehmen. In die Messkammer des Photometers wurde zunächst eine Küvette mit reiner 0,9 %-iger NaCL-Lösung eingesetzt, um den sog. Leerwert zu ermitteln, der bei den Messungen abgezogen wird. Dazu wurde der Deckel der Messkammer geschlossen und kurz gewartet bis der angezeigte Wert der Digitalanzeige kaum noch pendelte und dann der Knopf 'SetRef' am Photometer gedrückt. Nun wurde die Leerwert-Küvette wieder entnommen und die erste Küvette mit der Hefesuspension aus E2 kurz dreimal invertiert, um die eingebrachte Hefesuspension und die NaCL-Lösung gut zu durchmischen. Die Küvette wurde in das Photometer eingesetzt, der Deckel geschlossen und kurz gewartet, bis der Anzeigewert sich stabilisierte. Der Anzeigewert wurde notiert und die Küvette wieder dem Photometer entnommen. Nach der gleichen Vorgehensweise wurde mit den übrigen Küvetten der einzelnen Verdünnungsstufen verfahren, wobei vor jedem Messvorgang jeweils immer wieder der Leerwert ermittelt wurde.
Ergebnis:Die Messergebnisse der OD600nm-Messwerte des Photometers sind in der folgenden Tabelle zusammengefasst:
| Küvettennr. | Hefe-Konzentration in g/l | Hefekonzentration in % | OD600nm |
|---|---|---|---|
| 1 | 10 | 1 | 1,326 |
| 2 | 2,5 | 0,25 | 0,690 |
| 3 | 1,25 | 0,125 | 0,403 |
| 4 | 1 | 0,1 | 0,341 |
| 5 | 0,75 | 0,075 | 0,273 |
| 6 | 0,5 | 0,05 | 0,178 |
| 7 | 0,25 | 0,025 | 0,002 |
Die in ein Diagramm aufgetragene Messkurve der OD600nm-Werte gegen die Hefekonzentration in g pro l ist in der folgenden Abbildung dargestellt:
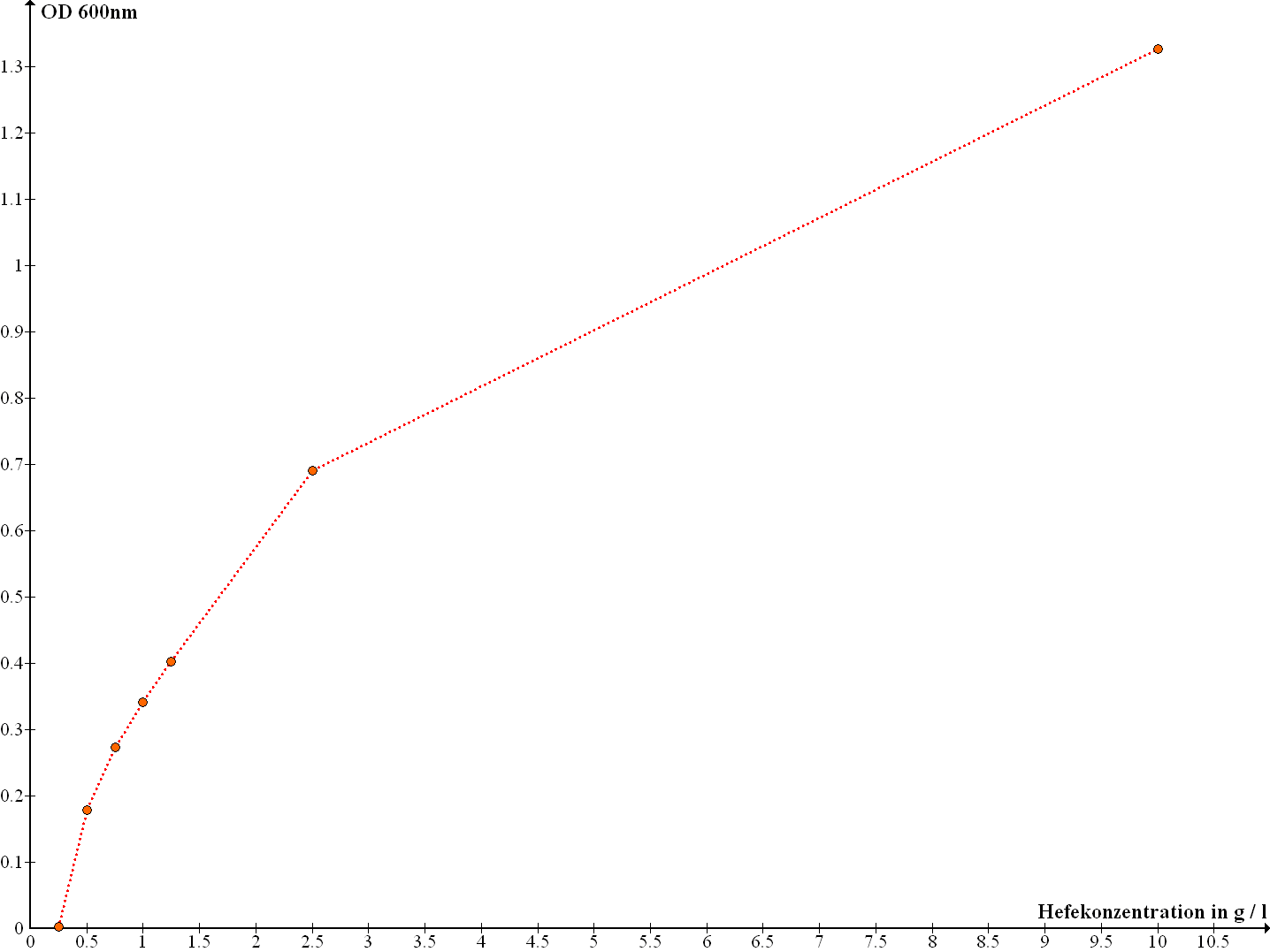
Abb. 1: Diagramm der OD600nm-Messwerte gegen die Hefekonzentration in g/l
Die Ergebnisse der photometrischen Bestimmung der OD600nm-Werte liegen erwartungsgemäss mit zunehmender Konzentration auf einer aufsteigenden Kurve, wobei in dem Diagramm deutlich wird, das sich keine lineare Abhängigkeit ergibt, sondern die Werte eher den Verlauf einer Sättigungskuve annehmen, was auf die Form des Lambert-Beer'schen Gesetz zurückzuführen ist. Setzt man die OD600nm-Werte in Abhängigkeit der Zählergebnisse der Thomakammer aus Versuch E1, so erhält man Gesamtzellzahl-Werte, die in der folgenden Tabelle dargestellt sind:
| Hefe-Konzentration in g/l | Hefekonzentration in % | OD600nm | Gesamtzellzahl Zellen/ml |
|---|---|---|---|
| 10 | 1 | 1,326 | 166,25 × 106 |
| 2,5 | 0,25 | 0,690 | 41,5625 × 106 |
| 1,25 | 0,125 | 0,403 | 20,78125 × 106 |
| 1 | 0,1 | 0,341 | 16,625 × 106 |
| 0,75 | 0,075 | 0,273 | 12,46875 × 106 |
| 0,5 | 0,05 | 0,178 | 8,3125 × 106 |
| 0,25 | 0,025 | 0,002 | 4,15625 × 106 |
In dem folgenden Diagramm ist das Verhältnis der OD600nm-Werte zu der Gesamtzellzahl, der aus der Zählung der Thomakammer extrapolierten Werte, dargestellt:
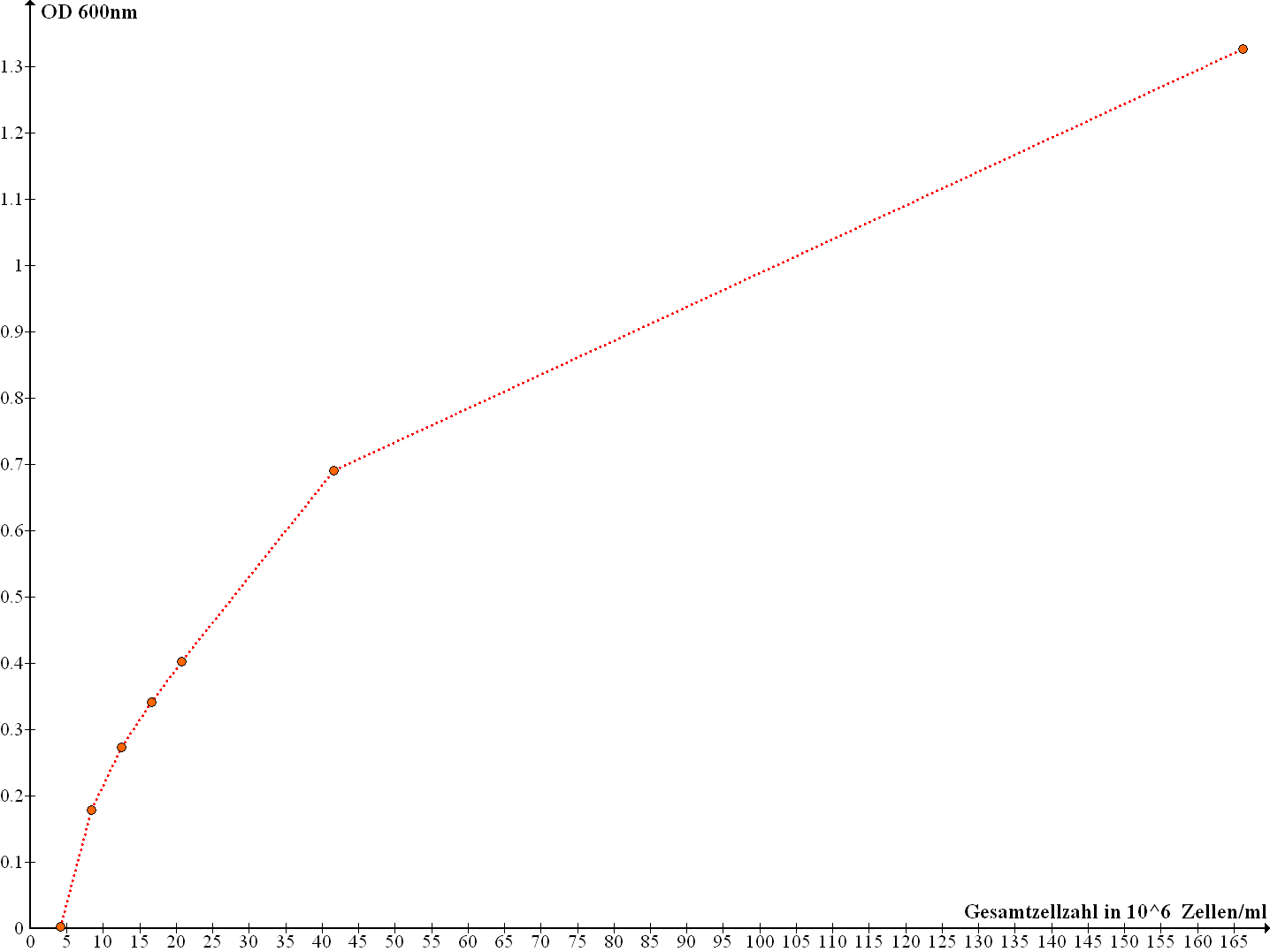
Abb. 2: Diagramm der OD600nm-Messwerte gegen die Hefegesamtzellzahl in 106 Zellen/ml
Inwieweit die OD600nm-Messwerte eine genaue Aussage über die Gesamtzellzahl geben können, darüber kann an dieser Stelle nur spekuliert werden,
da dazu sicherlich weitere Messreihen und Untersuchungen erfolgen müssten. Dagegen ist Darstellung der Abhängigkeit der OD600nm-Messwerte von der
Hefekonzentration zufiedenstellend.
Anzumerken ist, dass für jeden Messwert das Photometer neu gegen den Leerwert kalibriert werden musste, da es sich um älteres Gerät handelte, bei dem die
Lichtintensität aufgrund des gealterten Leuchtmittels mit zunehmender Betriebsdauer Intensitätsschwankungen unterliegt. Eine weitere mögliche Fehlerquelle
der Messreihe kann auch in der unzureichenden Durchmischung der Proben begründet sein, da diese direkt in der Küvette durch Umschwenken und nicht mittels eines
Reagenzglasmischgerätes durchmischt wurde.
Referenzen:
[1] Lyon, J.F., Thoma, R. (1881) 'Ueber die Methode der Blutkörperzählung', Archiv für pathologische Anatomie und Physiologie und für klinische Medicin, 84(1), 131-154, DOI: 10.1007/BF01935473
[2] Bast, E. 'Mikrobiologische Methoden', 2. Auflage, Spektrum Akademischer Verlag 2001
Die Graphiken der Abb. 1 und Abb. 2 wurden mit Hilfe der Software 'Graph', Version 4.3 Build 384 erstellt. Diese Software ist unter der GNU General Public Licence erhältlich unter www.padowan.dk.