Pflanzenphysiologie
- Protein-Extraktion -
- Versuch 3: Proteine: Proteinextraktion aus Sonnenblumen (Helianthus annus)
Einleitung:
Grüne Pflanzen sind als Photosynthese betreibende Organismen elementar auf Licht des sichtbaren Spektralbereichs angewiesen (s.a. Spektrum des sichbaren Lichts). Diese Abhängigkeit von der Lichteinstrahlung findet seine Entsprechung in verschiedenen physiologisch qualitativ und quantitativ erfassbaren Phänomenen wie dem Photo- und Heliotropismus, dem Streckungs- und Längenwachstums, der Regulation von Photosynthese- und Assimilationsraten, sowie des Wassertransports, der Blühinduktion u.v.a. Prozessen mehr. Um optimale Ausnutzung der zur Verfügung stehenden Lichteinwirkung zu gewährleisten, haben Pflanzen auf molekularer und genetischer Ebene in der Evolution diverse Regelmechanismen entwickelt. Dabei kommen photomorphogenen Mechanismen, also molekularen, genetischen und biochemischen Prozessen, die im direkten Zusammenhang mit der Lichteinwirkung stehen, besondere Bedeutung zu. Ein solches photomorphogenes Regulationssystem stellt das Phytochrom-System dar, welches in der Pflanze als Photorezeptor insbesondere von rotem und dunkelroten Licht fungiert und dabei eine Reihe verschiedener Anpassungs- und Regulationsfunktionen steuert oder an dessen Prozessierung beteiligt ist. Besonders gut lässt sich die Lichtwirkung auf die Pflanze während des Auskeimungsvorgangs bzw. dem kurz darauf folgenden Entwicklungsstadium beobachten, da hierbei auf eine Phase lichtunabhängiger Entwicklung, die als Skotomorphogenese bezeichnet wird und bei dem die sich entwickelnde Pflanze zunächst ihre Energie aus den Reservestoffen des Samens bezieht, ein Übergang auf eine Phase der lichtabhängigen Entwicklung, die als Photomorphogenese bezeichnet wird, erfolgt. Um Unterschiede in diesen Entwicklungsphasen aufzuzeigen, kann man die unterschiedliche Genexpression und die damit verbundenen unterschiedlichen Proteinmuster in Pflanzen, die unterschiedlichen Lichtbedingungen ausgesetzt sind, untersuchen und damit Rückschlüsse der Lichteinwirkung auf die Genexpression und u.U. auf die damit verbundenen Signalwege ziehen. [1]
Versuchsbeschreibung:
In diesem Versuch wurde von Keimlingen von Helianthus annus (Sonnenblume) eine Proteinfraktion extrahiert und diese mittels Gelelektrophorese auf einem Polyacrylamid-Gel aufgetrennt und anschliessend eine Coomassie-Färbung durchgeführt. Dabei wurden zwei Probenansätze untersucht, die verschiedenen Lichtbedingungen ausgesetzt waren: Bei beiden Proben erfolgte die Keimung im Dunklen, ein Probenansatz verblieb im Dunklen (6 Tage Wachstum), bei einem zweiten Probenansatz erfolgte Wachstum unter Langtagbedingungen (6 Tage, 16 h Licht bei 23° C).
Versuchsdurchführung:
Zunächst wurde je ein Keimling von der im Dunklen und der im Licht angezogenen Pflanzen eingehend untersucht und Unterschiede in der
Morphologie, insb. des Stengels, der Keimblätter und der Wurzeln qualitativ und quantitativ ermittelt.
Von einem im Licht angezogenen Keimling wurden die beiden Kotyledonen
(Keimblätter) in einen Porzellan-Mörser überführt, mit flüssigem Stickstoff versetzt und vorsichtig mit einem Pistill zerstossen bis ein
pulvriges Homogenisat erhalten wurde. Von diesem wurden einige Spatelspitzen in ein Eppendorf-Reaktionsgefäss mit vorgelegten 100 μl "Laemmli"-Puffer
(Extraktionspuffer, Zusammensetzung s.u.) überführt.
Diese Probe wurde gut durchmischt ("Vortex") und dann bei 95 ° C im Heizblock für 5 min. erhitzt. Anschliessend wurde die Probe bei 13000 rpm für
5 min. zentrifugiert und der entstandene Überstand mit einer Pipette in eine neues Eppendorf-Gefäss überführt.
Diese Probe wurde nochmals für 2 min. bei 95 ° C im Heizblock erhitzt und anschliessend wurden davon 5 μl entnommen und in eine Geltasche eines
diskontinuierliches SDS-Gels ("SDS-PAGE) (Zusammensetzung s.u.) pipettiert. In die anderen Geltaschen ("slots") des Gels wurden weitere
Proben und ein Protein-Marker mit Proteinfraktionen definierten Molekulargewichts (sog. "Unstained Protein Molecular Weight Marker") aufgetragen. Dann wurde
dem Gel für ca. 1 h eine elektrisches Feld von 15 mA Stärke angelegt, bis die Probenfront das Trenngel erreicht hatte; nun wurde die Stromstärke
für den Lauf der Proben durch das Trenngel auf 30 mA erhöht und für die Dauer von ca. 1,5 h angelegt.
Nach Ablauf der Gelelektrophorese wurde das gesamte Gel vorsichtig der Elektrophoresekammer entnommen, die das Gel einfassenden Glasplatten entfernt und das
Trenngel von dem Sammelgel abgetrennt. Das ausgeschnittene Trenngel wurde nun für 1 h in Fixierungslösung (Zusammensetzung s.u.)
inkubiert und anschliessend 3-mal für 10 min. in Wasser gewaschen. Nun erfolgte der eigentliche Färbevorgang durch Inkubation des Trenngels
in einer Coomassie-Färbelösung (Zusammensetzung s.u.) über Nacht in einer Schüttelwanne. Abschliessend wurde das
Gel in einer Entfärber-Lösung (Zusammensetzung s.u.) entfärbt und hernach fotographiert.
- 2% (w/v) SDS (Abk. für engl. Sodiumdodecylsulfate), Detergenz zur Denaturierung des Proteinanteils und gleichmässigen Ladungsverteilung
- 10 % Glycerin (w/v)
- 60 mM Tris-HCl, pH 6,8, Puffer zur Einstellung des pH-Wertes
- 0,1 M DTT (1,4-Dithiothreitol), Denaturierung von Proteinen durch Auflösung von Schwefelbrücken
- 0,005 % (w/v) Bromphenolblau, Farbstoff zur optischen Kontrolle des Probenauftrags und Probenlaufs im Gel
- 1,8 ml H2O
- 750 μl 0,5 M Tris-HCl pH 6,8
- 400 μl 30 % Acrylamid
- 30 μl 10 % (w/v) SDS
- 30 μl 10 % (w/v) APS (Ammoniumpersulfat)
- 3 μl 10 % (w/v) TEMED (N,N,N',N'-Tetramethylethylendiamin)
- 0,7 ml H2O
- 2,8 ml 30% Acrylamid
- 2,3 ml 1 M Tris-HCl pH 8,8
- 60 μl 10% (w/v) SDS
- 60 μl 10% (w/v) APS
- 3 μl TEMED
- 400 ml Methanol 40 % (v/v)
- 100 ml Essigsäure 10 % (v/v)
- 500 ml H2O
- 4 Teile Färbestocklösung (100 g/l Ammoniumsulfat; 1 % Phophorsäure; 0,1 % (w/v) Coomassie G250)
- 1 Teil Methanol
- 500 ml Methanol 50 % (v/v)
- 70 ml Essigsäure 7 % (v/v)
- 430 ml H2O
Ergebnisse:
Die Ergebnisse der Untersuchung der unter unterschiedlichen Lichtbedingungen angezogenen Keimlinge ist in der folgenden Tabelle dargestellt:
| Anzuchtbedingungen | Hypokotyl (Länge und Habitus) | Kotyledonen (Länge und Habitus) | Wurzel (Länge und Habitus) |
|---|---|---|---|
| Hell | 55 mm, grün | 20 mm, grün, waagerecht ausgerichtet, entfaltet, kleine Primärblätter | 80 mm, ausgeprägte Seitenwurzeln |
| Dunkel | 80 mm, weisslich | 7 mm, gelblich, nach unten abgewinkelt, entfaltet | 35 mm, wenige, kaum ausgeprägte Seitenwurzeln |
Die Ergebnisse der SDS-PAGE und anschliessenden Coomassie-Färbung des Polyacrylamid-Gels ist in der folgenden Abbildung dargestellt:
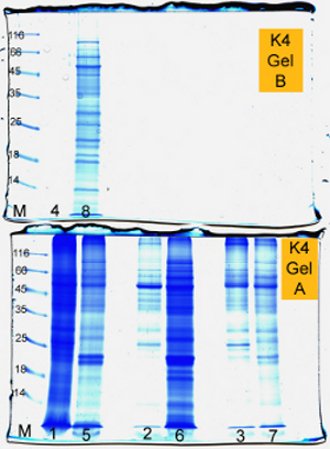
Abb. 1: Fotographie des Gels der SDS-PAGE von Proteinextrakten aus Keimlingen von Helianthus annus
Für die Nummerierungen der Gelbahnen gilt folgende Zuordnung: Bei den Bahnen der Nummern 1-4 handelt es sich um Probenaufträge der Proteinextrakte von im Hellen aufgezogenen Keimlingen, während es sich bei den Bahnen der Nummerierung 6-8 um Probenaufträge von im Dunkeln aufgezogenen Keimlingen handelt. Die mit M gekennzeichneten, "Strickleiter"-artigen, Bahnen am linken Bildrand sind Aufträge des Protein-Markers, die nebenstehenden Zahlen geben für das jeweilige Marker-Protein das dazugehörige Molekulargewicht in kDa an.
Ergebnisdiskussion:
Die Ergebnisse der optischen Untersuchung und der Vermessung der Keimlinge aus unterschiedlichen Anzuchtbedingungen veranschaulichen sehr deutlich, welche Auswirkungen das Licht auf ein auskeimende Pflanze hat. Während die unter Langtagbedingungen aufgezogenen Keimlinge eine 'normale' Entwicklung zeigen, mit grünen, nach der Richtung des Lichteinfalls ausgerichteten, Kotyledonen und ausgeprägtem Wurzelwachstum, weisen die im Dunkeln aufgezogenen Keimlinge das Phänomen des Etiolements auf. Dies äussert sich insbesondere im ausgeprägten Längenwachstum des Hypokotyls, im schwach ausgeprägten Wurzelwachstum mit kurzer Primärwurzel und wenigen Seitenwurzeln, sowie des Fehlens der Grünfärbung von Hypokotyl und der Kotyledonen. Auch sind die Kotyledonen nach unten abgewinkelt, da eine Ausrichtung der Keimblätter nach der Richtung des Lichteinfalls aufgrund der fehlenden Lichtquelle nicht möglich ist. Die fehlende Grünfärbung ist auf den Mangel an Chlorophyll zurückzuführen, was bestätigt, dass die Chlorophyllbildung und -akkumulation ein lichtinduzierter Prozess ist. Die mangelnde Wurzelausbildung steht ursächlich im Zusammenhang mit der fehlenden Möglichkeit der im Dunkeln angezogenen Pflanze Photosynthese zu betreiben und damit den für die Wurzelausbildung nötigen Gradienten im Wasserdampfdruck zwischen assimilierenden und transpirierendem Blattgewebe und wasseraufnehmenden Wurzelgewebe herzustellen. Somit zeigen etiolierte Keimlinge auf, wie weit die auskeimende Pflanze sich nur unter Verwendung der im Samen und Kotyledonen gespeicherten Reservestoffe entwickeln kann (Skotomorhogenese). Auf molekularer und genetischer Ebene lässt sich die abweichende Morphologie von etiolierten Keimlingen durch mangelnde Stimulation des Phytochrom-Systems erklären, welches als Rot-/Dunkelrotlichtrezeptor entscheidend an der Lichtperzeption und der transkriptionalen Regulation von lichtinduzierten Genprodukten von Pflanzen beteiligt ist. So konnte gezeigt werden, dass die Effekte der Etiolierung durch Rotlichteinstrahlung rückgängig gemacht werden konnte. Bei Keimlingen von Moosen der Gattung Polytrichum kann durch Rotlichteinstrahlung die Teilungsrate von Chloroplasten positiv beeinflusst werden. Auch anhand der quantitativ und qualitativ unterschiedlichen Zusammensetzung der Proteinfraktionen der unterschiedlich aufgezogenen Keimlinge lässt sich die Lichteinwirkung verdeutlichen. Alle Proben (mit Ausnahme der Bahn 4, die nicht bewertet werden kann) zeigen eine deutliche Bande im Bereich von 50 kDa. Bei dieser Bande kann mit grosser Wahrscheinlichkeit davon ausgegangen werden, dass es sich um die Bande des Enzyms RubisCO (Ribulosebisphosphat-Carboxylase/Oxygenase) handelt. Dieses sollte eigentlich bei den im Hellen aufgezogenen Pflanzen wesentlich deutlicher zutage treten als bei den im Dunkeln angezogenen Keimlingen, da RubisCO das primäre Enzym des Calvin-Cyclus und damit der Kohlenstofffixierung ist, welche wiederum verstärkt nur bei photosynthetisierenden Pflanzen betrieben werden kann. Grundsätzlich kann der Calvin-Cyclus auch bei Dunkelheit, also ohne Photosynthese ablaufen, wie z.B. bei C4-Pflanzen, aber um dauerhaft und in grösserem Umfang betrieben werden zu können, ist er auf die Photosynthese-Produkte ATP und NADPH angewiesen. Die doch recht deutliche Bande der "Dunkel"-Keimlinge deutet entweder darauf hin, dass RubisCO schon während der Skotomorphogenese verstärkt gebildet wurde oder dass die Pflanzen nach Entfernung aus der Dunkelkammer schon einige Zeit im Licht verbracht hatten, so dass schon ausreichend RubisCo gebildet werden konnte. Auf letztere Vermutung deutet auch die Tatsache hin, dass die Kotyledonen der "Dunkelkeimlinge" bereits entfaltet waren. Insgesamt sieht man aber an den Banden der unterschiedlichen Proben eine unterschiedliche Verteilung und Bandenstärke der Proteinfraktionen über den gesamten Gellauf, was eine unterschiedliche Genregulation und -expression unter verschiedenen Lichtverhältnissen aufzeigt. Bei den 'Dunkelproben' 5-7 lässt sich ausserdem im Unterschied zu den anderen Probenaufträgen eine deutliche Doppelbande im Bereich zwischen 18 und 25 kDa erkennen. Dabei könnte es sich um die Untereinheiten von RubisCO handeln, insbesondere wenn man bedenkt, dass Phytochrom-regulierte Prozesse u.U. sehr schnell (innerhalb weniger Minuten) von der Pflanze umgesetzt werden, so dass wenige Minuten Belichtung ausreichen, der Pflanze zu signalisieren, dass eine Umstellung von der Skotomorphogenese auf die Photomorphogenese erfolgen soll. [1]
Referenzen: